瘦体超敏者 LMHR
<markdown>
瘦体超敏者无法避免动脉粥样硬化
我想强调一篇新发表的、引起大量社交媒体关注的论文:斑块产生斑块,ApoB 不会:来自 KETO-CTA 试验的纵向数据。
该研究的重点是所谓的瘦体超敏者 (LMHR),这些人的 LDL-C 水平非常高,但体重正常,代谢健康。
过去几年来,戴夫·费尔德曼一直“谨慎乐观”地认为,瘦体超敏者 (LMHR) 独特的代谢环境可能保护免受通常认为与 LDL 升高相关的心血管风险。
我支持这个假设。事实上,就在这项研究发表的几周前,我参加了戴夫的播客节目,分享了我的观点:
> 心脏病复杂且多因素。尽管载脂蛋白B(apoB,LDL颗粒内的脂蛋白)是动脉粥样硬化形成的诱因,但合理的推测是,良好的代谢健康或许能够抵消apoB和LDL升高所预期的部分风险增加。*
换句话说,尽管 LMHR 的 apoB 和 LDL 浓度升高,但可能在某种程度上可以预防动脉粥样硬化。
有一项由Adrian Soto-Mota领导,戴夫·费尔德曼 Dave Feldman、 Nick Norwitz和Matthew Budoff 博士共同撰写的研究首次以前瞻性、数据驱动的方式验证了这一想法。仅凭这一点,就值得高度赞扬。
## 这项研究的目的是什么?
Keto-CTA研究最初旨在评估一年内非钙化冠状动脉斑块体积(NCPV)的变化。该研究的预注册文件( NCT05733325)明确阐述了这一点,在已发布的方案中进行了重申。

然而,当实际研究发表时,这一主要结果几乎完全被忽视了。
作者不再将非钙化冠状动脉斑块体积(NCPV)作为中心终点,而是重新定义了研究目的,强调斑块进展的预测因素。这种转变在已发表论文的措辞中清晰可见,甚至在研究的中心插图中也能看出这一点,其中的目标似乎已悄然从“测量斑块”转变为“了解预测斑块的因素”。
我们会在讨论结果时深入探讨这个问题,但这里值得暂停一下。为了事后分析而淡化预先设定的主要结果是一个很大的危险信号,尤其是在主要发现不符合作者预期的情况下。同行评审本应发现这种选择性报告。
除了非钙化冠状动脉斑块体积(NCPV) 之外,作者还报告了一些其他与斑块相关的参数,如冠状动脉钙化 (CAC)评分和动脉粥样硬化体积百分比 (PAV),以及血脂与这些斑块标志物之间的关联。
为了获得参与资格,人们必须满足严格的纳入标准:
* 坚持生酮饮食超过 2 年
* 开始生酮饮食后 LDL-C 升高≥50%
* 生酮状态下 LDL-C ≥190 mg/dL,但生酮饮食前≤160 mg/dL
* 高密度脂蛋白胆固醇≥60毫克/分升
* 甘油三酯≤80毫克/分升
* 糖化血红蛋白<6.0%,空腹血糖<110毫克/分升
* 超敏C反应蛋白<2毫克/升
* 无高血压、2 型糖尿病、临床甲状腺功能减退症
* 不使用任何改变脂质的药物或补充剂
* 无遗传学证实的家族性高胆固醇血症
这可以说是迄今为止为研究这个问题而组建的最干净的代谢队列之一。这些瘦体超敏者(LMHR)处于巅峰状态——体型瘦削,代谢健康指标完美无瑕,除了极高的低密度脂蛋白胆固醇(LDL-C)水平(范围在202至308毫克/分升之间)。
有趣的是,仅仅招募100名参与者就花了数年时间。这一点鲜为人知,但值得关注,因为许多瘦体超敏者LMHR可能并不像自认为的那样健康,这也是这项研究招募如此困难的原因。
最初帮助设计这项研究的Spencer Nadolsky博士在 X 上提出了这一观点。

不幸的是,Keto-CTA 研究没有对照组。早期计划招募代谢健康、 LDL-C 水平正常且无升高的成年人进行对照组(Nadolsky 博士已证实),但最终未能实现,可能是由于资金限制。这种缺失极大地限制了我们对相对风险的评估。
无论如何,让我们看看这项研究表明了什么(以及没有表明什么)。
## 瘦体超敏者LMHR 显示不稳定斑块进展加速
从主要结果开始:非钙化冠状动脉斑块体积(NCPV)。
选择它作为主要终点是有充分理由的。NCPV 指的是冠状动脉内尚未硬化成钙的柔软、不稳定斑块的体积。与更稳定且更容易检测的钙化斑块不同,非钙化斑块更容易破裂,从而可能引发血栓、心脏病发作或中风。
这使得 NCPV 成为动脉粥样硬化的早期且具有临床意义的标志物,可以在疾病出现症状或危及生命之前发出信号。
然而,尽管NCPV很重要,但在已发表的论文中却几乎没有提及。唯一真正提到它的是图1A,该图显示了一年内个体层面的变化。文中没有报告任何数字,作者只是评论说*“大多数参与者的NCPV表现稳定”。*

但当看图时,这种解释并不成立。每条线代表一位参与者,虽然少数人看起来稳定,但大多数人的NCPV明显上升,尤其是那些基线值较高的人。
临床医生和研究人员注意到了这一点,并在社交媒体上表达了担忧。作为回应,主要作者 Adrian Soto-Mota分享了论文中缺失的实际数字: NCPV 的中位数增幅为 18.8 立方毫米^,^比作者本人在研究方案中预测的7 立方毫米增幅高出 2.5 倍以上。

那么,与其他人群相比如何?
在PARADIGM 研究中,无代谢综合征的成年人NCPV 在 3.2 年内平均增加了 10.3 立方毫米^。^而患有代谢综合征的成年人同期^NCPV^平均增加了 17.8 立方毫米。
这意味着瘦体超敏者 LMHR 组一年内增加的量(18.8 立方毫米^)^相当于代谢综合征患者三年内通常增加的量。

在另一项由马修·布多夫博士(也是 Keto-CTA 研究的合著者)共同撰写的研究中,患有血脂异常和高血压(但无糖尿病)的成年人的 NCPV 在 3 年内增加了 28.9立方毫米,即每年约 9.6 立方毫米^。^同一项研究中,2 型糖尿病患者 3 年内的变化量为 52.3 立方毫米^,^即每年约 17.4 立方毫米^。^
再次,瘦体超敏者 LMHR 达到每年 18.8立方毫米,与 2 型糖尿病相当。
我向布多夫博士提出了这个问题,但尚未听到答复。

最后,在SMARTool项目中,该项目招募了吸烟、肥胖、糖尿病、高血压和血脂异常的参与者,非他汀类药物使用者的年度NCPV增幅仅为6.4立方毫米^。^对于他汀类药物使用者,这一增幅仅为1.0立方毫米^。^尽管LMHR人群体型较瘦且无代谢性疾病,但他们的斑块进展速度几乎是这些未服用他汀类药物的高危参与者的三倍。

已发表的 Keto-CTA 论文完全没有提及这种背景。这令人担忧。数据并不支持 LMHR 表型能够预防动脉粥样硬化的观点。相反,似乎与不稳定斑块的加速进展有关——比许多低密度脂蛋白胆固醇 (LDL-C) 水平较低的代谢不健康人群的病情更严重。
值得一提的是:许多潜在的LMHR参与者因不符合严格的纳入标准而被排除在研究之外。如果这是该群体中最健康的子集,那么对于更广泛的未达标的LMHR人群来说,数据会是什么样子呢?
这或许可以解释为什么初选结果被掩盖了。结果与一些人所期待的并不相符。
## 瘦体超敏者LMHR 显示总斑块负担令人担忧的增长
现在让我们来看看 Keto-CTA 研究中报告的另一个关键结果:动脉粥样硬化斑块体积百分比 (PAV)。PAV
测量动脉壁内积聚的斑块(无论是否钙化)数量,以占血管总体积的百分比表示。它是心脏病学试验中的一个重要指标,常用于衡量干预措施是否能够减缓、阻止或逆转动脉粥样硬化的进展。
我们可以在补充材料中找到LMHR和其他几项研究的PAV中值变化。作者指出:“PAV的中值变化为0.8%,NCPV和PAV值与其他队列在两次访视中观察到的值相当。”
让我们来揭开这个谜团。
LMHR患者的PAV中位数增幅为0.8%。值得注意的是,基线时冠状动脉钙化(CAC)评分为0的患者PAV增幅较低(0.5%),而CAC评分>100的患者PAV增幅则更高,为2.4%。

乍一看,这些数字似乎并不罕见。补充表中列出的其他研究报告称,PAV 的年增长率在 0.3% 到 1.0% 之间。但问题在于:这些对照组的健康状况远不如LMHR 组。
正如Gladstone Brookes 在 X 上强调的那样,其他研究中的参与者通常高血压、肥胖、糖尿病、血脂异常的发生率较高,并且基线 CAC 评分也高得多。然而,尽管代谢受损,他们的斑块进展速度却与 LMHR 相似或更低,而后者本应代表“低风险”人群。
为了更清楚地说明这一点,在Nakanishi 等人的研究中,尽管只有 13% 的参与者的 CAC 评分为零,而 69% 的参与者的 CAC 评分超过 100,但平均 PAV 增幅为 0.7%。这 0.7% 的增幅比 Keto-CTA 研究中 CAC >100 的 LMHR 所经历的增幅 (2.4%) 低三倍多。
PARADIGM 研究的亚组分析调查了 1,000 多名未患冠状动脉疾病的成年人,结果显示,10 年动脉粥样硬化性心血管疾病风险较低的人群的 PAV 增加 0.45%,风险中等的人群的 PAV 增加 0.58%,风险高的人群的 PAV 增加 0.99%。

最健康的LMHR(CAC评分为零,属于低风险类别)的PAV仍然增加了0.5%,与“不太健康”的同龄人持平,甚至更糟。与此同时,CAC评分超过100的LMHR的PAV增幅是高风险人群平均水平的2.4倍。
对此没有任何积极的看法。
Keto-CTA 研究强烈表明,尽管 LMHR 体型较瘦、胰岛素敏感且无炎症,其斑块进展速度仍与代谢不健康的个体相同或更高。事实上,CAC 评分较高的人群,其斑块进展速度明显低于心血管风险状况相似甚至更严重的对照组。
我们必须记住:这些是研究人员能找到的最健康的LMHR。许多其他人因不符合严格的代谢健康标准而被筛选掉。可以合理地假设,如果进行研究,那些被排除在外的人可能会面临更大的风险。
综合起来,PAV 和 NCPV 的研究结果强烈表明,LMHR 表型并不能预防动脉粥样硬化。即便没有传统的风险因素,也可能与斑块进展加速相关。
## 关于“异质性”
Keto-CTA 作者在社交媒体上发布的一个比较令人困惑的回应是,极力强调 LMHR 队列内部的异质性。简而言之,他们指出,虽然有些人经历了快速且显著的斑块增长,但其他人却没有。
正如戴夫在 X 上解释的那样,他们正在撰写另一篇后续论文,探讨为什么某些 LMHR 比其他 LMHR 进展更快。

我认为这是一个有价值且必要的研究方向。了解为什么有些人比其他人更容易受到影响,是迈向个性化风险评估和更精准临床决策的关键。
但不要只见树木不见森林。
这种对变异性的关注似乎分散了人们对研究核心发现的注意力:平均而言,瘦体超敏者(LMHR)斑块生长加速。平均值和中位数不会说谎。作为一个群体,他们并没有受到保护,无法避免动脉粥样硬化。
这就像因为一些重度吸烟者寿命长、没有心脏病就认为吸烟无害一样。诚然,每个群体中都存在例外。但这并不能否定吸烟总体上会增加心血管风险的压倒性证据。
同样的逻辑也适用于此。
所以可以肯定的是,一些 瘦体超敏者(LMHR) 可能具有独特的保护因素,例如其遗传、免疫特征、脂蛋白亚型等。我对未来的研究非常感兴趣,这可能有助于确定谁更容易或更不容易受到伤害。
但在此之前,现有数据清楚地表明,LMHR表型与动脉粥样硬化的快速进展相关。无论群体内存在多大的个体差异,这一点都不应被忽视或轻视。
## 斑块进展与 LDL-C 或 Apo-B 之间没有联系?
尽管围绕斑块进展存在诸多令人担忧的发现,但作者选择将焦点完全集中在其他方面:斑块体积变化与 apoB 水平之间缺乏关联,而 apoB 是一种被广泛认为是导致动脉粥样硬化发展的蛋白质。
这个想法启发了这篇论文的标题“斑块引发”,因为基线斑块负担(如 CAC 评分)比脂质水平更能预测疾病进展。

公平地说,这是一个有趣的观察。
但问题在于:研究中每位参与者的LDL-C(202-308毫克/分升)和apoB(149-214毫克/分升)浓度都非常高。因此,作者试图在已经升高的数值的窄带范围内寻找关联。这就像试图只招募每天吸烟2到4包的人来研究吸烟的影响一样。
如果你发现该群体的吸烟强度与患病率之间没有关联,你会得出结论说香烟不会造成危害吗?当然不会。你会说:“我们需要将这些吸烟者与不吸烟者进行比较。”*这个问题在这里也存在。
Keto-CTA 研究缺乏一个由代谢健康、apoB 和 LDL 水平正常或较低的成年人组成的对照组,这意味着无法解答 apoB 水平过高是否会导致动脉粥样硬化这个更广泛的问题。没有这种比较,就无法确定 apoB 水平过高是否是这些瘦体超敏者(LMHR) 患者斑块进展如此迅速的原因。
事实上,ApoB很可能是该队列中斑块生长加速的因果因素。这些参与者是特意挑选出来的,因为他们的代谢健康,那么还有什么可以解释他们风险升高呢?
这个问题仍需调查,但如果有的话,Keto-CTA 数据强化了人们的担忧:在心血管风险方面,极高的 apoB 水平可能会覆盖其他代谢健康迹象。
## 最后的想法
我必须为戴夫和他的同事们致以热烈的掌声,感谢他们促成了这项研究。对100人进行为期一年的跟踪调查,并深入了解他们的心血管疾病风险,这绝非易事,尤其对于一个被广泛讨论却从未被深入研究过的群体而言。
话虽如此,正如我在 X 上所说,Keto-CTA 研究的要点不容忽视:LMHR 表型并不能预防动脉粥样硬化。相反,它似乎与比我们预期更严重的斑块进展相关,即使在代谢健康状况良好的情况下也是如此。

是的,研究中的一些人确实表现出轻微的斑块生长,未来的研究有望揭示哪些人受到保护,哪些人没有受到保护的区别。但就目前情况而言,在体型精瘦且代谢健康的情况下,以极高的LDL-C和apoB为特征的LMHR表型应被视为心血管风险因素。 就像吸烟和糖尿病一样,其结果也存在差异。并非所有吸烟者都会患心脏病。并非所有2型糖尿病患者都会患动脉粥样硬化。但这并不意味着我们不再将这些疾病视为风险。 同样的逻辑也适用于此。 https://alexleaf.com/lean-mass-hyper-responders-are-not-protected-from-atherosclerosis/ </markdown>
D:2025.04.15<markdown> 对 LMHR 运动的感谢信 值得花一点时间来感谢戴夫·费尔德曼和他的同事们,他们帮助澄清了长期存在有关脂质学和心血管健康领域的网上社交媒体争论(专家已经得出结论,低密度脂蛋白 (LDL) 是导致心脏病的因素) 。 LMHR(“瘦体超敏者”)现象源于一系列个人轶事、热情的自我实验以及对观察数据的选择性解读。随着时间的推移,该理论逐渐演变成一个更广泛的概念:低密度脂蛋白胆固醇(LDL)极度升高,如果伴有其他指标,例如低甘油三酯和高密度脂蛋白(HDL),则可能在某种程度上是良性的。 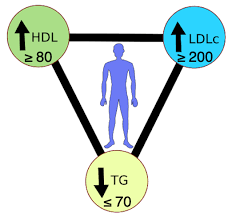 <https://cholesterolcode.com/our-paper-on-low-carb-ldl-cholesterol-and-the-lmhr-phenotype-is-now-finalized/> 经过近十年的大力推动,这一假设终于接受了正式的检验:KETO-CTA研究。 尽管最初对该研究的设计和伦理监督存在担忧(包括考虑到可预见的风险,IRB 的批准似乎出奇的宽松),但最终的数据清楚地说明了这一点。 在 100 名遵循生酮饮食且 LDL 升高的个体中,非钙化斑块体积 (NCPV) 在短短一年内显著增加: * 个体层面的数据表明,斑块负担的中位进展很明显(图 1)。 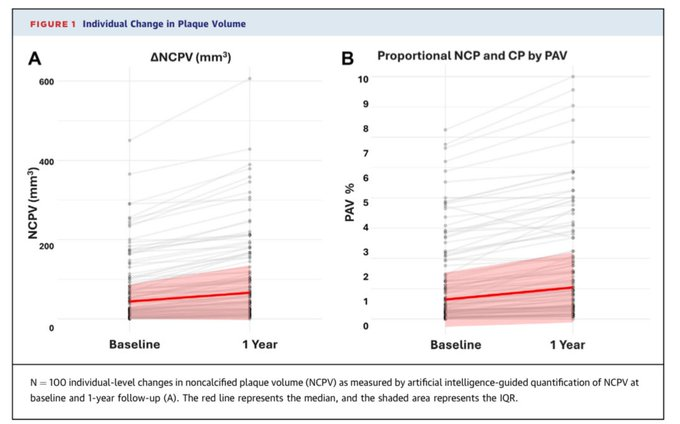 Figure 1: <https://www.jacc.org/doi/10.1016/j.jacadv.2025.101686> * 动脉粥样硬化斑块体积百分比 (PAV) 的年进展率总体平均为0.8% — 明显高于可比人群的进展率(图 2)。  Via @Pl4ntbased * 在高风险亚组中(基线 CAC > 100 或 10 年 CVD 风险 > 5%),进展进一步加速,达到每年 1.4% 至 2.4% 。 * 以体积为基础,非钙化斑块体积的年增加量达到18.8 立方毫米/年——明显低于对照组,即使在患有糖尿病、脂蛋白 a 升高或其他高危特征的人群中也是如此(图 3)。 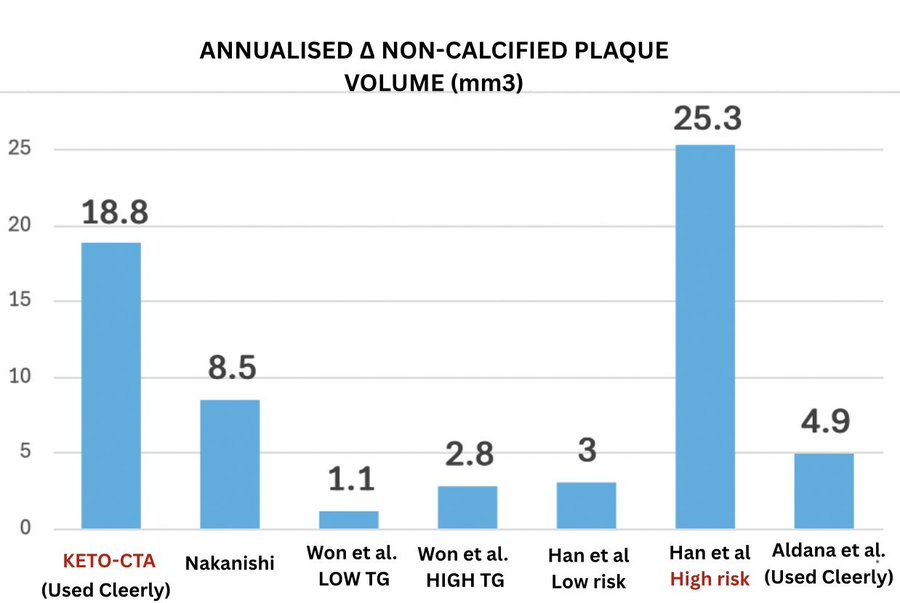 Via @Pl4ntbased 这些发现至关重要。表明,尽管存在良好的表面标志物——瘦体重、低甘油三酯、高高密度脂蛋白(HDL),但严重的高胆固醇血症仍然会导致动脉粥样硬化。 从某种程度上来说,这对该领域来说是一项重要的贡献。关于高水平LDL在“代谢健康”背景下是否无害的争论,如今已得到实证证据的解答。事实并非如此。 当然,叙事已经在发生变化。一些研究人员现在强调反应的“异质性”,这意味着虽然有些人病情进展迅速,但其他人病情仍然相对稳定。这是一个引人入胜的故事,但也是一个危险的故事。 统计上的存活率并不能消除总体风险。 仅仅因为十个人中有三个人可能在高速车祸中不系安全带而幸存,并不意味着不系安全带驾驶是明智之举。公共卫生建议并非为少数幸运儿制定,而是为了保护大多数人。 同样,通过饮食控制故意诱导ApoB和LDL水平飙升仍然是一种高风险策略。无论多少次重新思考,都无法改变这一根本现实。 最后,需要提醒大家的是: 作者建议,可以对该队列进行更多年随访,以观察其长期结局。如果这样做,必须充分告知参与者目前已记录的风险,明确提供和讨论降低风险的策略,例如降脂治疗。继续监测这些个体而不提供充分的信息披露和干预措施,将进入伦理上站不住脚的境地。 我们对这些参与者以及广大公众负有更大的责任。 https://x.com/MichaelAlbertMD/status/1916175837549731889 </markdown>
D:2025.04.29<markdown> Shivani Misra(医学学士/医学博士、哲学博士、皇家内科医学院院士) 如果您身处我的领域,您几乎肯定读过最近发表的 Keto-CTA 研究。它引起了不小的轰动——主要是因为人们对其方法、统计数据和结论的严谨性提出了严重质疑——而这本身就是一个备受争议的研究领域。我读过这篇文章,我并非想再次批判其科学性(我已经做过很多其他文章了)。我感兴趣的是,这件事反映了学术研究的文化——以及为什么像这样有缺陷的研究总是被漏掉。这不仅仅是一篇论文的问题。它指出了我们所处的体系中更深层次的缺陷——激励机制、盲点以及偷工减料。如果我们想要提高学术研究的质量和可信度,我们就必须愿意直面这些系统性问题。以下是一些个人思考:1. 从根本上说,没有什么可以阻止你进行糟糕的研究。这是一个残酷的事实。我们投入了大量的时间和金钱,却从未致力于提供真正答案的研究。严谨性、资源和机遇的丧失让人深感沮丧。为什么这种情况不断发生?2. 偏见很强大。当研究人员深陷于某个假设或有书要卖时,很难保持客观。但为了科学,为了患者,我们应该退一步,挑战我们自己的假设。我在自己的领域一次又一次地看到这种情况。在我看来,将个人精力投入到研究假设中会造成巨大的利益冲突。3. 同行评审制度失效。谁没有推荐过一位他们认为友善的审稿人?但是,当一篇论文跳过其主要结果而仍然做出笼统的结论时,很明显,审稿人要么没有受过足够的培训,要么也执着于同一假设。4. 缺乏监督的作者身份是危险的。资深作者在发表后与研究对象划清界限,这是一个令人震惊的控诉,表明资深 PI 的监督是多么的少。我们都认识一些署名论文却从未读过的人……这种事必须停止。5. 为什么要发布新闻稿来宣传一项没有对照组的观察性研究?像这样的研究竟然被如此公开地宣传,真是令人费解。但这反映了展现“影响力”的压力——有时甚至要以牺牲质量或谨慎为代价。这项研究暴露了学术体系的端到端缺陷。最大的输家是那些放弃时间参与研究的患者,以及那些与这项研究相关的人,他们因为错误的结论而做出与自身健康相关的决定。糟糕的研究比没有研究更糟糕!很想知道您的想法。https ://lnkd.in/eGzNqQn3 </markdown>





