目录
胰岛素抵抗
<markdown>
**碳水会导致胰岛素抵抗吗?**
2023 年 9 月 20 日
这是我关于胰岛素抵抗原因的第二篇博客文章。在第一篇题为“胰岛素抵抗的原因:个人脂肪阈值”的文章中,我讨论了内脏脂肪、异位脂肪和低度慢性炎症在胰岛素抵抗发展中的作用,引入了一个称为“个人脂肪阈值”的概念。
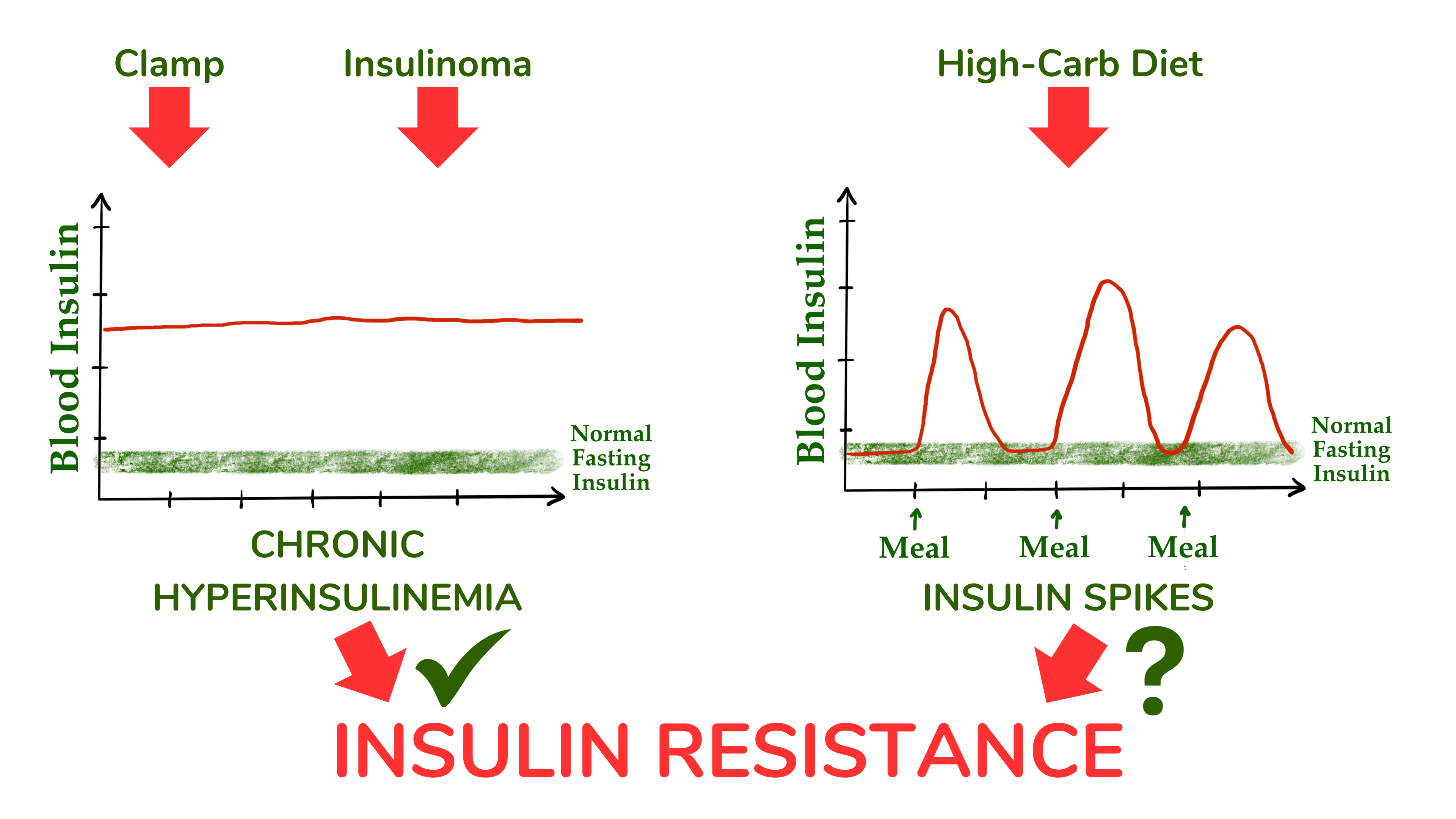
然而,很明显,并非所有胰岛素抵抗病例都与体脂量过多有关。您可能在视频、社交媒体或某些低碳水饮食书籍中听说过,胰岛素抵抗是胰岛素水平长期升高(高胰岛素血症)的结果,而胰岛素水平又被认为是过量食用高碳水食物的结果(见下图)。
膳食碳水化合物引发胰岛素抵抗的拟议机制
本文研究是否有科学证据支持高胰岛素血症和膳食碳水化合物是胰岛素抵抗的原因。
为此,首先研究胰岛素水平升高(高胰岛素血症)是否会导致胰岛素抵抗,然后查阅有关高碳水饮食是否确实会导致胰岛素抵抗的科学文献,以及相反的,低碳水饮食是否会改善胰岛素敏感。
**高胰岛素血症会导致胰岛素抵抗吗?**
有两条证据可以阐明胰岛素浓度升高是否会导致胰岛素抵抗。第一个来自高胰岛素正常血糖钳夹研究,第二个基于患有胰岛素瘤的患者。
**钳夹研究中高胰岛素血症导致的胰岛素抵抗**
第一个证据是来自高胰岛素正常血糖钳夹研究的数据。为了解释这个过程,需要了解一些技术知识。钳夹是一种用于测量胰岛素抵抗的临床程序,非常复杂,需要大量的专业知识,因此几乎只在研究的背景下完成。
在手术过程中,研究人员不断地将胰岛素注入血液中。注射胰岛素以达到特定的胰岛素水平,例如轻微升高或非常升高。如果将胰岛素持续注入血液中,会发生什么?胰岛素会阻止肝脏产生葡萄糖,导致肌肉和脂肪细胞从血液中吸收葡萄糖。如果不清楚,请查看我写的关于血糖调节的博客文章。
这些胰岛素作用的结果是血糖水平开始下降。在钳夹过程中,研究人员不断测量血糖水平,将葡萄糖直接注入血液中,以确保血糖水平保持稳定在正常范围内。在某些人身上,研究人员需要注射很少的葡萄糖来保持血糖水平稳定,而在另一些人身上,则需要注射大量葡萄糖。
那么请想一想:从这个测试中了解一个人的胰岛素敏感性什么?
研究人员测量了他们需要输注多少葡萄糖才能将血糖水平稳定在正常范围内。由此产生的测量结果称为葡萄糖输注速率(GIR),这是胰岛素敏感性的直接测量。如果一个人对胰岛素非常敏感,那么胰岛素水平升高会导致他们的肌肉和脂肪细胞从血液中吸收大量葡萄糖。因此,他们需要输入大量额外的葡萄糖以保持血糖水平稳定。这意味着对于胰岛素非常敏感的人来说,葡萄糖输注率会很高。
然而,如果有人有胰岛素抵抗,那么他们将需要很少的葡萄糖来保持血糖水平稳定。他们的 葡萄糖输注速率GIR 会很低。
好的,这是衡量健康人胰岛素敏感性的金标准。但是,我为什么要提到这一点呢?这是否告诉我们一些胰岛素抵抗的原因?
是的,有可能。两项已发表的研究表明,在这种钳夹过程中维持升高的血液胰岛素和正常的血糖水平数小时后,身体会逐渐变得越来越胰岛素抵抗。
例如,Del Prato 及其同事观察到,连续 4 天的高胰岛素正常血糖钳夹可使健康年轻人的胰岛素敏感性降低 20-40%。同样,Rizza 及其同事发现,40 小时的高胰岛素钳夹(胰岛素水平保持在与肥胖男性和女性相同的水平)确实会导致胰岛素抵抗。
现在,从这些数据来看,我们不能 100% 确定确实是高胰岛素水平导致了胰岛素抵抗。问题是,只有通过注入葡萄糖才能在较长时间内安全地维持如此高的胰岛素水平,并且葡萄糖需要被吸收到肌肉和脂肪细胞中。因此,几个小时的高胰岛素血症导致的胰岛素抵抗也可能是细胞过度摄取糖分的结果,即能量毒性,我们在关于个人脂肪阈值假说的博客文章中对此进行了讨论。我个人并不认为能量毒性完全解释了这些结果,因为参与者在钳夹期间通过调整可以吃的食物量以适应注入的葡萄糖量来保持能量平衡。因此,我最好的解释仍然是,这种情况下的胰岛素抵抗是高胰岛素血症本身的结果。然而,应该清楚,这些数据并不完全是结论性的。
**胰岛素瘤导致的胰岛素抵抗**
然而,科学研究的另一个领域确实提供了额外的证据,表明胰岛素水平升高本身可能是胰岛素抵抗的一个原因,这是基于一种称为胰岛素瘤的疾病。
胰岛素瘤是一种胰腺良性肿瘤,会导致胰岛素过量产生。根据肿瘤的大小,全天产生的胰岛素量可能仅比健康人略微升高或高出几倍。
由于胰岛素抑制肝脏产生葡萄糖,同时使细胞能够从血液中摄取葡萄糖,因此胰岛素瘤的主要临床表现是低血糖,即低血糖水平(<70 mg/dL或<3.9 mmol/L)。如果胰岛素瘤患者保持完全的胰岛素敏感性,那么他们会因低血糖而很快死亡。然而,并不能保持完全的胰岛素敏感。几项 临床 研究清楚地表明,这些患者因其病情而变得相当胰岛素抵抗,在大多数研究中,其水平远高于根据其年龄和体重指数 (BMI) 预期的水平。此外,一旦通过手术切除胰岛素瘤,并且胰岛素的慢性过度分泌停止,胰岛素敏感就会恢复正常。
同样,该文献并未将高胰岛素血症与胰岛素抵抗完美联系起来。例如,至少有一篇出版物表明,手术切除胰岛素瘤可以明显减少内脏脂肪量。这表明胰岛素瘤可能在内脏脂肪的积累中发挥了作用,并且由于内脏脂肪被认为是胰岛素抵抗的关键决定因素,因此目前不能排除高胰岛素瘤患者至少部分是胰岛素抵抗的可能性。内脏脂肪量增加的结果,而不是高胰岛素血症本身。这是因为其他已发表的胰岛素瘤患者研究与体脂量的一般指标(例如体重指数(BMI))相匹配,但没有测量内脏脂肪量,因此无法评估胰岛素瘤患者的胰岛素抵抗增加到什么程度。这些患者的原因可能是内脏脂肪量增加。
**结论:高胰岛素血症会导致胰岛素抵抗吗?**
总而言之,钳夹研究和胰岛素瘤的证据强烈表明,高胰岛素水平可能是胰岛素抵抗的一个原因,至少在高胰岛素血症持续数小时至数天的情况下是如此。
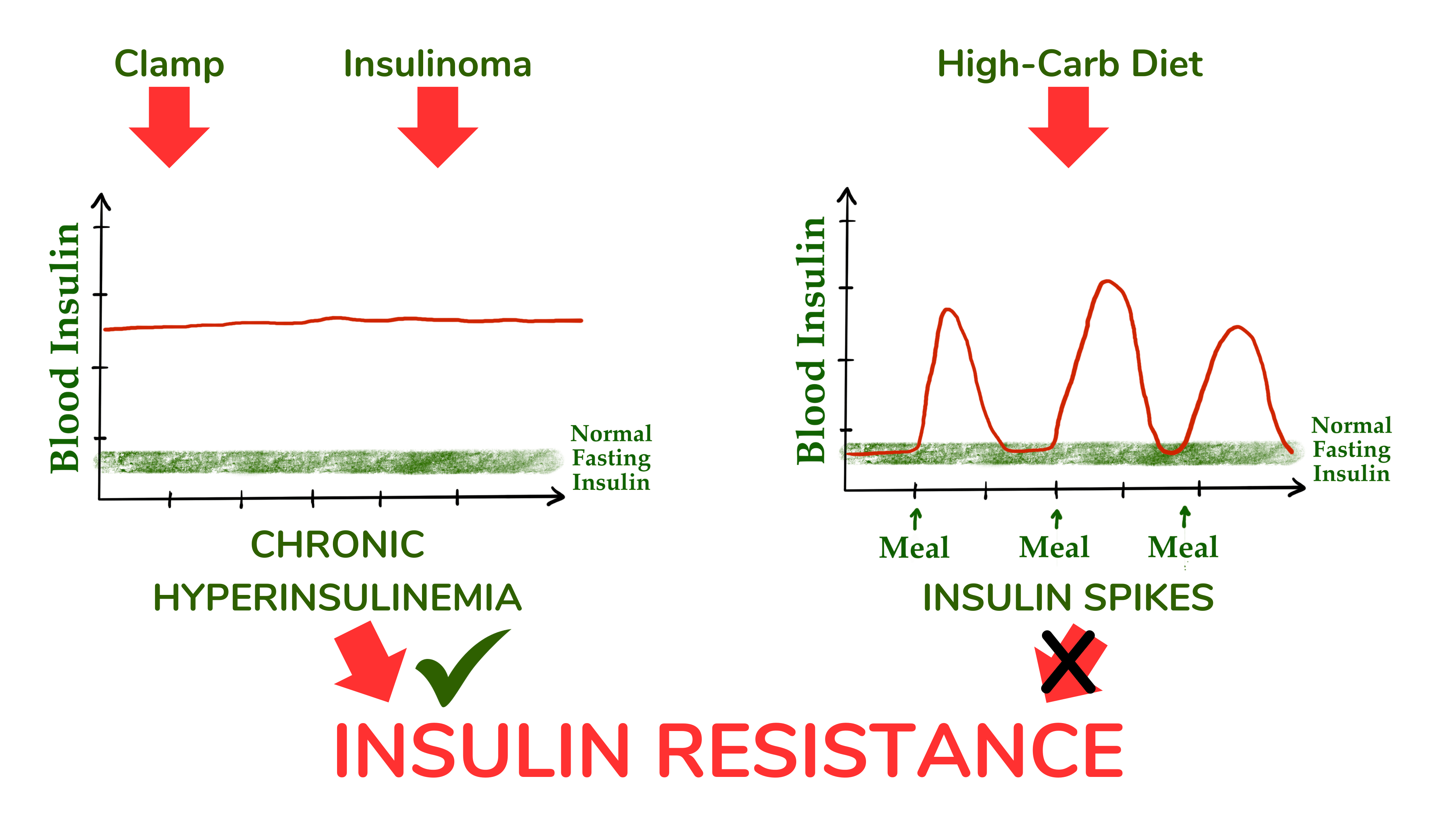
目前尚不清楚的一个问题是,当吃富含碳水化合物的食物时,血液中胰岛素水平的正常生理性上下波动是否可能同样引发胰岛素抵抗,这是一个重要的考虑因素。在钳夹研究和胰岛素瘤患者中,胰岛素水平持续数小时至数天,慢性高胰岛素血症的影响很可能与吃高碳水食物时胰岛素水平通常的上下波动有很大不同。
因此,虽然我认为这篇文献提供了长期升高的血液胰岛素水平可能导致胰岛素抵抗的证据,但尚不清楚这是否也适用于饮食碳水化合物引起的胰岛素暂时增加。
虽然钳夹研究和胰岛素瘤患者表明,长期升高的血液胰岛素浓度会引发胰岛素抵抗,但这些数据不能应用于高碳水饮食人群中血液胰岛素的脉动性暂时增加。
**高碳水饮食会导致胰岛素抵抗吗?低碳水饮食会改善胰岛素敏感吗?**
因此,我们需要做的是评估临床喂养研究的科学证据,在这些研究中,参与者的饮食中碳水化合物含量差异很大。我们感兴趣的具体问题是高碳水饮食是否会减少而低碳水物饮食是否会增加胰岛素敏感。
许多研究表明,低碳水、极低碳水或生酮饮食的人的胰岛素敏感明显增加。然而,一些 最常被引用的研究并没有控制热量摄入量和体重变化,在这些研究中,研究参与者在减轻体重的同时提高了胰岛素敏感。这并不是对这些研究的批评;而是对这些许多研究的设计目的不是为了研究低碳水与高碳水饮食对胰岛素敏感的影响。这当然具有实际意义,因为这些研究证明了低碳水饮食的一个关键好处,即减肥,这些研究不能告诉我们胰岛素敏感的改善是否是碳水摄入量减少的结果,还是或体重和体脂量的减少。
因此,我寻找饮食干预研究,其中
(a) 为参与者提供的饮食中碳水化合物含量差异很大;
(b) 测量胰岛素敏感;
© 其中饮食成分对胰岛素敏感的影响可以与体重减轻的影响分开。
其中© 点意味着由于热量摄入量受到控制,两组中的体重都没有变化,或者饮食研究组的热量摄入量和体重减轻是匹配的。
我在下表中总结了这些研究,比较了高碳水与低碳水研究对胰岛素敏感的独立体重影响。
比较低碳水与高碳水饮食对体重变化相匹配的参与者胰岛素敏感影响的研究概述。
让我们回顾一下其中的一些研究,以了解所做的工作和发现的内容。值得注意的是,为了准确地代表这些研究,全面了解这些饮食对胰岛素敏感的影响,本节在讨论钳夹研究的结果时不可避免地会涉及技术性内容。
有几项规模非常小的研究(Bischop中 n=6, Lundsgaard中 n=9 ,Chokkalingam中 n=10 ),持续时间也很短(11 天、3 天和 6 天)。然而,这些都是交叉设计研究,意味着每个参与者都完成了每个饮食干预阶段,因此可以直接与自己进行比较。所有三项研究都采用了胰岛素敏感的金标准测量方法,即高胰岛素正常血糖钳夹。最后,在所有三项研究中,参与者在高碳水饮食条件下摄入的碳水化合物至少是低碳水饮食条件下的五倍,即高碳水和低碳水饮食条件下的碳水化合物摄入量存在很大差异。
看一下比绍普Bisschop或伦兹加德Lundsgaard首先撰写的研究,就会发现,低碳水饮食中,参与者摄入的碳水化合物非常少,大部分是脂肪,而高碳水饮食中,参与者摄入的主要是碳水化合物,脂肪很少(蛋白质和能量摄入量是匹配的)。这些研究在一个重要方面有所不同:比绍普研究的参与者获得了符合其能量需求的流质食物,而伦兹加德研究的参与者则获得了常规食物,但远远超出了他们的能量需求。
Bisschop 团队发现,低碳水饮食后肝脏胰岛素敏感降低,还发现全身胰岛素敏感降低的趋势,因为低碳水饮食后低/基础胰岛素浓度下的 GIR 降低,并且在高胰岛素条件下会减少。
> ## 基于高胰岛素正常血糖钳夹的胰岛素敏感测量 > > 在高胰岛素正常血糖钳夹中,通常获得两种胰岛素敏感测量值,两者都很重要。 > > 一是需要以高胰岛素浓度输注葡萄糖以将血糖“钳制”在正常范围内的速率。葡萄糖输注率(GIR)是衡量胰岛素将葡萄糖从血液输送到细胞(主要是肌肉和脂肪细胞)的能力的一个关键指标,因此也是衡量全身胰岛素敏感的指标。由于葡萄糖输注速率与细胞在稳态条件下(即胰岛素和葡萄糖水平变化不大)吸收葡萄糖的速率相同,因此 GIR 通常也称为葡萄糖消失速率Rd。 > > 在钳夹过程中,研究人员通常还会测量胰岛素抑制肝脏葡萄糖释放的能力。这有时称为葡萄糖出现率或 Ra。Ra 可以在低基础胰岛素浓度下和钳夹的高胰岛素阶段进行测量。 > > 总而言之,胰岛素敏感性的两个主要测量方法是通过评估 GIR/Rd 的全身胰岛素敏感性和通过评估 Ra 的肝脏胰岛素敏感性。
伦德斯加德等人发现,与高碳水饮食相比,低碳水饮食的全身和肌肉胰岛素敏感性较低。然而,低碳水饮食后,肝脏胰岛素敏感性更高。这就是为什么我在上表中将这个结果评为混合的原因。
Chokkalingam 团队发现,采用低碳水和高碳水饮食 6 天后,全身胰岛素敏感性在低碳水饮食后更高。尽管肝脏胰岛素敏感性没有差异,但这些数据可以作为低碳水饮食后胰岛素敏感性改善的证据。
Kirk 团队使用并行设计进行的随机对照试验也值得注意。肥胖参与者被随机分为高碳水或低碳水饮食,并在 48 小时后进行研究,以相当于 7% 的体重减轻进行再次研究。在匹配的体重减轻中,低碳水饮食中的 HOMA-IR 降低程度更大,这与低碳水饮食中肝脏胰岛素敏感性的更大改善一致。然而,两个饮食组的肌肉和全身胰岛素敏感性改善相似,但没有明显差异。
在另一项平行设计随机对照试验中,布拉德利团队将超重或肥胖患者随机分配到两种热量限制饮食中的一种:低碳水饮食和高碳水饮食。两者均进行了 8 周的随访,导致了类似的体重减轻。随着体重减轻,两个饮食组的全身和肝脏胰岛素敏感性均有所改善,但各组之间没有差异。
在一项平行设计研究中,Frankenberg 团队将碳水化合物含量相当低的高脂肪饮食(占总能量摄入量的 27%)与高碳水饮食(占总能量摄入量的 62%)进行了比较,蛋白质和能量摄入量也相匹配。本次试验的所有食物均向参与者提供,为期 4 周。通过钳夹测量,高碳水饮食后参与者的胰岛素敏感性明显升高。
这里考虑的最大的研究是由加德纳团队进行的(DIETFITS 试验),招募了 609 名 BMI 较高的男性和女性,被随机分配到健康的低碳水或高碳水饮食,遵循这些饮食一整年。这项研究的控制不太好,因为没有向参与者提供食物,但研究人员仍然设法在完成研究的 481 名参与者中实现了在整个 1 年期间各组之间碳水化合物摄入量的明显差异。这两种饮食导致了类似的体重减轻。这项研究并不是主要关注胰岛素敏感性,也不包括胰岛素敏感性的金标准测量。然而,报告了标准化口服葡萄糖耐量试验中的空腹胰岛素水平和30分钟胰岛素浓度,这两者都可以被视为胰岛素敏感性的低质量指标。
Aronica 团队发表的论文是对 DIETFITS 试验的二次数据分析,该试验的受试者为一小群参与者,这些参与者的饮食与低碳水生酮饮食或超低脂肪(以及高碳水)饮食一致。需要谨慎地解释这样的二次分析,在对累积证据的评估中给予较少的重视。但值得注意的是,这两个组的 HOMA-IR 均有所改善,且组间没有差异变化。
另一项值得注意的研究是 OMNICARB 试验,提供了一些关于高碳水饮食是否可能引发胰岛素抵抗的线索(Sacks 等人,2017)。)。这些研究人员随机抽取 163 名超重成年人,让他们食用四种不同饮食中的两种或多种,每种饮食持续 5 周。这是一项非常大规模的交叉设计研究,所有食物和饮料都提供给参与者,这对于这种规模的研究来说是不寻常的。饮食中碳水化合物含量要么低要么高,升糖指数要么低要么高。因此,如果比较极端情况,一种饮食的碳水化合物含量相对较低(尽管占总热量的 40%,并不是真正的低碳水饮食),仅包含低升糖指数食物,升糖负荷为 64。另一种饮食的碳水含量较高,而高碳水食物大多是高升糖指数食物,升糖负荷为172,比低碳水低升糖指数饮食高2.7倍。
还可以在这里讨论更多的研究,但这些研究要么比较了碳水含量相当相似的饮食,例如Perez-Jimenez 团队的试验,要么由Shikany 领导的妇女健康倡议的文献;或者有重大的研究设计或报告缺陷,例如卡特勒等人的研究。和洛夫乔伊等人。; 或者是在患有明显 2 型糖尿病的患者中进行的,例如Garg 等人的试验。和帕里洛等人。然而,值得注意的是,将这些研究与上表中显示的研究一起考虑并不会改变本文的总体结论。
**总结与结论**
考虑到累积的证据,似乎很明显,随意食用的低碳水饮食 通常会导致超重或肥胖人群体重减轻。还有强有力的证据表明,体重减轻显然与胰岛素敏感性的改善相关,特别是对于那些减掉最多内脏脂肪和异位脂肪的人来说。
然而,这种胰岛素敏感效应在任何减肥过程中都会出现,包括减肥手术、药物或其他饮食导致的体重减轻,因此评估低碳水饮食与高碳水饮食对体重稳定或重量匹配的条件下胰岛素敏感性的影响至关重要。在控制体重或匹配减肥程度的研究中,低碳水饮食的胰岛素敏感并不明显较高,而高碳水饮食也没有明显导致胰岛素抵抗。
许多已发表的研究规模较小,而其他研究则采用了不完善的胰岛素敏感性测量方法,因此目前的证据并不完美。然而,相对大量的研究使用金标准高胰岛素正常血糖钳夹技术来测量胰岛素敏感性。此外,许多研究中都提供了所有食物,大多数研究中都很好地控制了重要变量,例如热量或蛋白质摄入量。因此,虽然尚不完全结论,但现有证据表明饮食中碳水化合物(和脂肪)含量本身并不是胰岛素敏感的主要决定因素。
现在,为什么钳夹研究中的高胰岛素血症或胰岛素瘤患者会引发胰岛素抵抗,而高碳水饮食却不会?考虑到这些研究中测试的研究饮食的碳水化合物含量存在显著差异,可以肯定的是,高碳水饮食组全天的胰岛素浓度一定更高。
其一,钳夹研究和胰岛素瘤患者的高胰岛素血症的性质是慢性的,胰岛素水平升高数小时至数天。这与高碳水饮食引起的血液胰岛素水平的定期波动非常不同。
高碳水或低碳水饮食的其他成分也可能抵消碳水化合物引起的血液胰岛素升高可能产生的影响。因为当人们吃这些低碳水和高碳水饮食时,在这些研究中以及在现实生活中,不会吃单独的碳水化合物或脂肪,在高碳水饮食中吃大量面包、米饭、面食和水果,在低碳水饮食中吃奶制品、肉类、坚果、油、黄油和奶油。我们应该清楚,尽管研究人员设计的这些饮食的碳水化合物和脂肪含量不同,但最终的饮食在许多其他方面也有所不同,其中许多也可能影响胰岛素敏感性。换句话说,由于摄入更多碳水化合物而导致的血液胰岛素水平的正常上下可能确实会导致一些胰岛素抵抗,但这种影响会被饮食中的其他一些成分所抵消。这也可以解释为什么研究结果存在如此大的差异。这基本上表明一些隐藏的因素在起作用,这很可能只是因为每个研究小组实施这些饮食的方式可能略有不同。
为了进行这项分析,我查阅了基于 20 项临床试验的 21 份出版文献,但我无法发现可以解释为什么结果如此异质的特定模式。我有一些假设,例如,在高碳水饮食中使用更精制碳水的研究可能比在高碳水饮食中加入主要复杂的富含纤维的碳水来源的研究结果更糟糕。事实似乎并非如此,因为从论文中可以确定,大多数研究似乎主要使用全谷物、豆类、水果和蔬菜作为高碳水饮食中的高碳水物。我还想知道脂肪、蛋白质或纤维含量是否会影响整体结果。我不能自信地排除这种可能性,但我也无法检测到特定的模式。
换句话说,从现有的研究中,我无法自信地确定解释广泛发现的机制。然而,我们可以明确地说的是,对于体重稳定的人来说,摄入更多或更少的碳水化合物对胰岛素敏感性几乎没有影响。
这可能会让一些人感到失望,因为如果降低碳水摄入量确实可以改善胰岛素敏感,那么工具箱中就会有一个相当简单的工具来治疗胰岛素抵抗。然而,这也可以被视为积极的一面,因为这些数据为人们在饮食选择上提供了更多选择,而不会带来胰岛素抵抗的风险。换句话说,如果饮食中碳水化合物含量高,无论出于何种原因,都没有充分的理由认为这本身会产生胰岛素抵抗,不像低碳水饮食圈子中经常下的结论那样。
我还想澄清的是,这些数据不应被视为表明所有高碳水物饮食对每个人来说都是不错的选择。许多碳水化合物的食物来源,例如精制谷物和添加糖,升糖指数高,纤维含量低,提供的微量营养素很少。这里讨论的数据不应该给任何人这样的印象:大量食用此类食物对其健康具有中性影响。上面讨论的大多数研究都包括基于全食物的碳水化合物来源,例如全谷物、豆类、蔬菜和水果。这并不奇怪,但值得明确指出的是,这些饮食干预试验的研究人员并没有在高碳水饮食中给参与者喂食主餐是糖果和饮料。因此,重要的是要明确富含精制谷物和添加糖的高碳水饮食对胰岛素敏感(和其他健康指标)的影响可能比这些数据显示的更严重。同样明显的是,高碳水饮食可能会给葡萄糖不耐症患者带来问题,例如糖尿病前期,特别是糖尿病患者。
本文中讨论的研究在高碳水饮食组中主要使用碳水化合物的全食物来源,例如全谷物、豆类、蔬菜和水果,结果不应推断为主要由精制谷物组成的高碳水饮食,以及添加糖。
同样重要的是,这些数据不应被视为表明低碳水饮食对血糖调节没有任何好处。低碳水饮食持续帮助人们减肥这一事实是一个关键好处,而低碳水饮食的低升糖负荷对于葡萄糖耐受不良的人来说是一个内在的优势。简而言之,如果有葡萄糖不耐症,这意味着无法安全地将血糖水平保持在正常范围内,在这种情况下,减少每餐后需要处理的葡萄糖量似乎是一个好主意。我将在后面的博客文章中详细讨论这一点。
总之,现有数据强烈表明,持续高血液胰岛素浓度(如高胰岛素钳夹或胰岛素瘤患者)会导致这些情况下的胰岛素抵抗。然而,高碳水饮食引起的血液胰岛素水平的生理正常上下似乎不会独立引发胰岛素抵抗。当考虑到体重或体脂量的变化时,低碳水饮食似乎也没有提供独特的胰岛素增敏作用。
虽然慢性高胰岛素血症(如钳夹研究或胰岛素瘤患者所见)似乎会导致胰岛素抵抗,但对于因摄入高碳水饮食而导致的胰岛素暂时增加似乎并非如此。
请允许我最后说一句:我经常看到人们通过引用一两项具体研究来争论碳水化合物会导致胰岛素抵抗,或者低碳水饮食可以逆转胰岛素抵抗。我还看到有人声称高碳水饮食可以提高胰岛素敏感性。许多人似乎认为科学研究意味着,如果“x导致y”的陈述,所需要做的就是找到一两篇论文来支持这个陈述。根本不是这样的。正如在上表中所看到的,可以找到一两项研究来支持任何立场。必须明确这不是一种基于证据的方法,这一点至关重要。基于证据意味着考虑全部累积证据,而不仅仅是支持自己观点的少数研究。请注意这一点,保护自己免受错误信息的侵害。
**参考**
- 加斯塔尔德利。在临床和研究环境中测量和估计胰岛素抵抗。肥胖 2022;30:1549-63。
- 德尔普拉托等人;持续生理性高胰岛素血症和高血糖对人类胰岛素分泌和胰岛素敏感性的影响。糖尿病学1994;37:1025-35。
- 里扎等人;人类高胰岛素血症产生胰岛素抵抗。糖尿病学1995;28:70-5。
- 斯克哈等人;胰岛素瘤和肥胖2型糖尿病患者胰岛素敏感性的比较。激素和代谢研究1996;28:595-8。
- 庞特里罗利等人;用于低血糖患者研究的葡萄糖钳夹技术:胰岛素抵抗作为胰岛素瘤的一个特征。内分泌学研究杂志 1990;13:241-5。
- 弗尼卡等人;在胰岛素瘤患者中观察到胰岛素敏感性严重但可逆的降低。内分泌学年鉴2018;79:30-6。
- 齐木等人;减少胰岛素瘤患者手术后的内脏肥胖。动脉粥样硬化和血栓形成杂志2004;11:209-14。
- 科利卡等人;极低热量生酮饮食的功效和安全性:双盲随机交叉研究。欧洲医学和药理学科学评论 2017;21:2274-89。
- 保利等人;生酮饮食对患有多囊卵巢综合症的超重女性的影响。转化医学杂志2020;18:104。
- 科恩等人;生酮饮食可以减少患有卵巢癌或子宫内膜癌的女性的中心性肥胖和血清胰岛素。营养杂志2018;148:1253-60。
- 卢科宁等人;生酮饮食对非酒精性脂肪肝患者肝脂肪变性和肝线粒体代谢的影响。美国国家科学院院刊 2020;117:7347-54。
- 沃莱克等人;极低碳水化合物和低脂饮食对超重女性空腹血脂、低密度脂蛋白亚类、胰岛素抵抗和餐后血脂反应的比较。美国营养学院学报2004年;23:177-84。
- 巴拉德等人;饮食碳水化合物限制可改善服用他汀类药物的个体的胰岛素敏感性、血压、微血管功能和细胞粘附标记物。营养研究2013;33:905-12。
- 比绍普等人;膳食脂肪含量改变健康男性胰岛素介导的葡萄糖代谢。美国临床营养杂志2001;73:554-9。
- 阿罗尼卡等人;与生酮和超低脂饮食模式相关的体重、胰岛素抵抗、血脂和饮食质量变化:DIETFITS 随机对照试验的二次分析。2023 年营养前沿;10:1220020。
- 伦兹加德等人;膳食脂质与碳水化合物过量对胰岛素敏感性的相反调节。糖尿病 2017;66:2583-95。
- 乔卡林加姆等人;高脂肪/低碳水化合物饮食减少了胰岛素刺激的碳水化合物氧化,但刺激了人类的非氧化葡萄糖处理:骨骼肌丙酮酸脱氢酶激酶的重要作用 4。临床内分泌与代谢杂志2007;92:284-92。
- 柯克等人;在热量限制期间,膳食脂肪和碳水化合物会不同程度地改变胰岛素敏感性。胃肠病学2009; 136:1552-60。
- 布拉德利等人;**低脂肪与低碳水化合物减肥饮食:对减肥、胰岛素抵抗和心血管风险的影响:一项随机对照试验。**糖尿病 2009;58:2741-8。
- 加德纳等人;低脂肪与低碳水化合物饮食对超重成人 12 个月体重减轻的影响以及与基因型模式或胰岛素分泌的关联:DIETFITS 随机对照试验。美国医学会杂志2018;319:667-79。
- 萨克斯等人;**膳食碳水化合物的高血糖指数与低血糖指数对心血管疾病危险因素和胰岛素敏感性的影响:OmniCarb 随机临床试验。**美国医学会杂志2014;312:2531-41。
- 冯·弗兰肯伯格等人;**高脂肪、高饱和脂肪饮食可降低体重稳定的超重和肥胖受试者的胰岛素敏感性,但不会改变腹内脂肪。**欧洲营养杂志2017;56:431-43。
- 佩雷斯-希门尼斯等人;**地中海和高碳水化合物饮食可以改善健康年轻人的葡萄糖代谢。**糖尿病学2001;44:2038-43。
- 希卡尼等人;**妇女健康倡议 (WHI) 饮食调整试验中低脂饮食干预对葡萄糖、胰岛素和胰岛素抵抗的**影响。美国临床营养杂志2011;94:75-85。
- 加格等人;高、低碳水化合物饮食对轻度NIDDK患者血浆脂蛋白和胰岛素敏感性的影响比较。糖尿病 1992;41:1278-85。
- 帕里洛等人;**高单不饱和脂肪/低碳水化合物饮食可改善非胰岛素依赖型糖尿病患者的外周胰岛素敏感性。**新陈代谢1992;41:1373-8。
- 卡特勒等人;**低碳水化合物饮食改变细胞内葡萄糖代谢,但不会改变运动训练受试者的总体葡萄糖处理。**新陈代谢1995;44:1264-70。
- 洛夫乔伊等人;**控制高脂肪与低脂肪饮食对非裔美国和白人女性胰岛素敏感性和瘦素水平的影响。**新陈代谢1998;47:1520-4。
- 葛等人;14 种流行的膳食计划的膳食常量营养素模式比较,以减少成人体重和心血管危险因素:随机试验的系统回顾和网络荟萃分析。英国医学杂志 2020;369:m696。
- 古德帕斯特等人;**减肥对肥胖患者局部脂肪分布和胰岛素敏感性的影响。**糖尿病 1999;48:839-47。
- 马科斯等人;**中度和随后的渐进性减肥对肥胖症患者代谢功能和脂肪组织生物学的影响。**细胞代谢2016; 23:591-601。
- 约翰逊等人;热量限制提高久坐肥胖成人胰岛素敏感性的机制。糖尿病2016;65:74-84。
https://nourishedbyscience.com/do-carbs-cause-insulin-resistance/
</markdown>
D:2023.10.16<markdown>
**胰岛素抵抗的原因:个人脂肪阈值**
发布于 2023 年 9 月 6 日
作为血糖水平调节系列的一部分,本文讨论了体重过大和体脂量如何成为胰岛素抵抗的主要原因的科学。具体来说,将讨论一个至关重要的概念,称为个人脂肪阈值假设。
**体重和脂肪量与胰岛素抵抗有关**
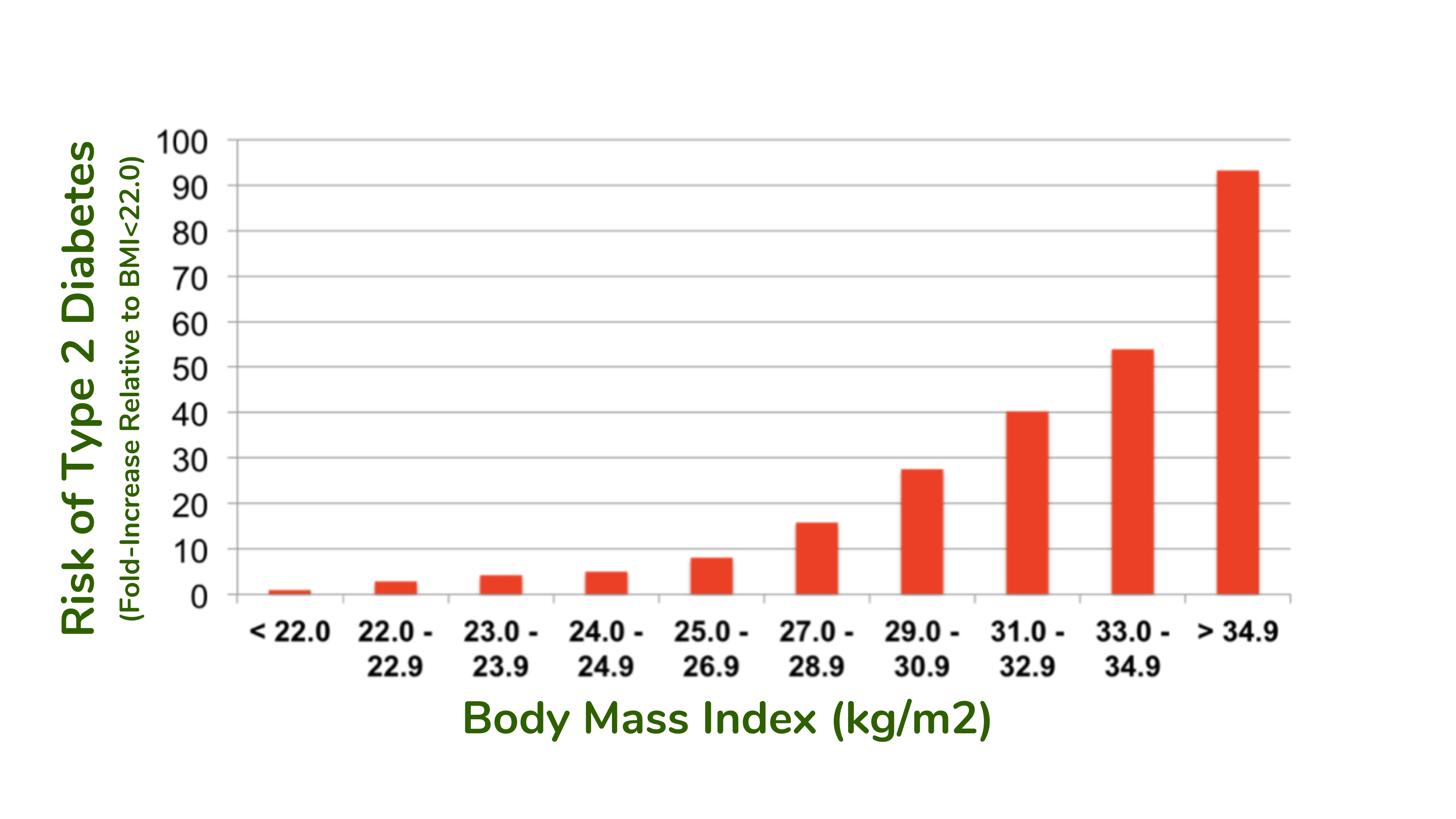
在观察性研究中,发现体重指数 (BMI) 与患 2 型糖尿病的风险之间存在很强的关联。在护士健康研究中,例如,对超过 114,000 名基线时无糖尿病的护士进行了研究。14 年来,患糖尿病的风险与基线 BMI 密切相关(见下图)。在最高 BMI 类别中,基线 BMI 为 35 或更高的人,患糖尿病的风险比最低 BMI 类别的人高 93 倍。不是高 93%,而是高 93 倍。即使我们应该承认 BMI 并不是体脂的完美衡量标准,正如稍后将在本文中讨论的那样。我们还需要承认,观察性研究中的相关性并不能证明体脂较多会导致2型糖尿病。但是,看到如此强烈的相关性,并在众多研究中一致地看到,就像这里的这种关系一样,确实提供了更高水平的信心,即因果性可能是观察到的相关性的基础。
护士健康研究中体重指数 (BMI) 与 14 年内患 2 型糖尿病的风险之间的关系(最低 BMI 类别的风险 = 1)
然而,我们想知道的是,为什么有额外的体重,特别是脂肪量,会大大增加患 2 型糖尿病的风险。
正如我在关于血糖调节的博客文章中更详细讨论的那样,糖尿病是一种身体失去将血糖水平保持在正常范围内的能力的疾病。葡萄糖耐量有多好取决于三个因素:胰岛素敏感、胰腺β细胞产生胰岛素的能力(通常称为β细胞功能)以及不依赖于胰岛素的葡萄糖处理(其中葡萄糖有效性和运动引起的)肌肉细胞对葡萄糖的摄取可能是最重要的两个。
一般来说,当体重增加时,确实倾向于看到β细胞功能和葡萄糖有效性也会恶化,但也有最多证据证明的最深刻的转变是,体重增加通常与胰岛素抵抗的增加有关。本文的目的是讨论体重和胰岛素抵抗之间的联系,以及当体重增加导致胰岛素抵抗时体内实际发生的情况。
因此,先了解体重增加与胰岛素抵抗增加之间的关系。
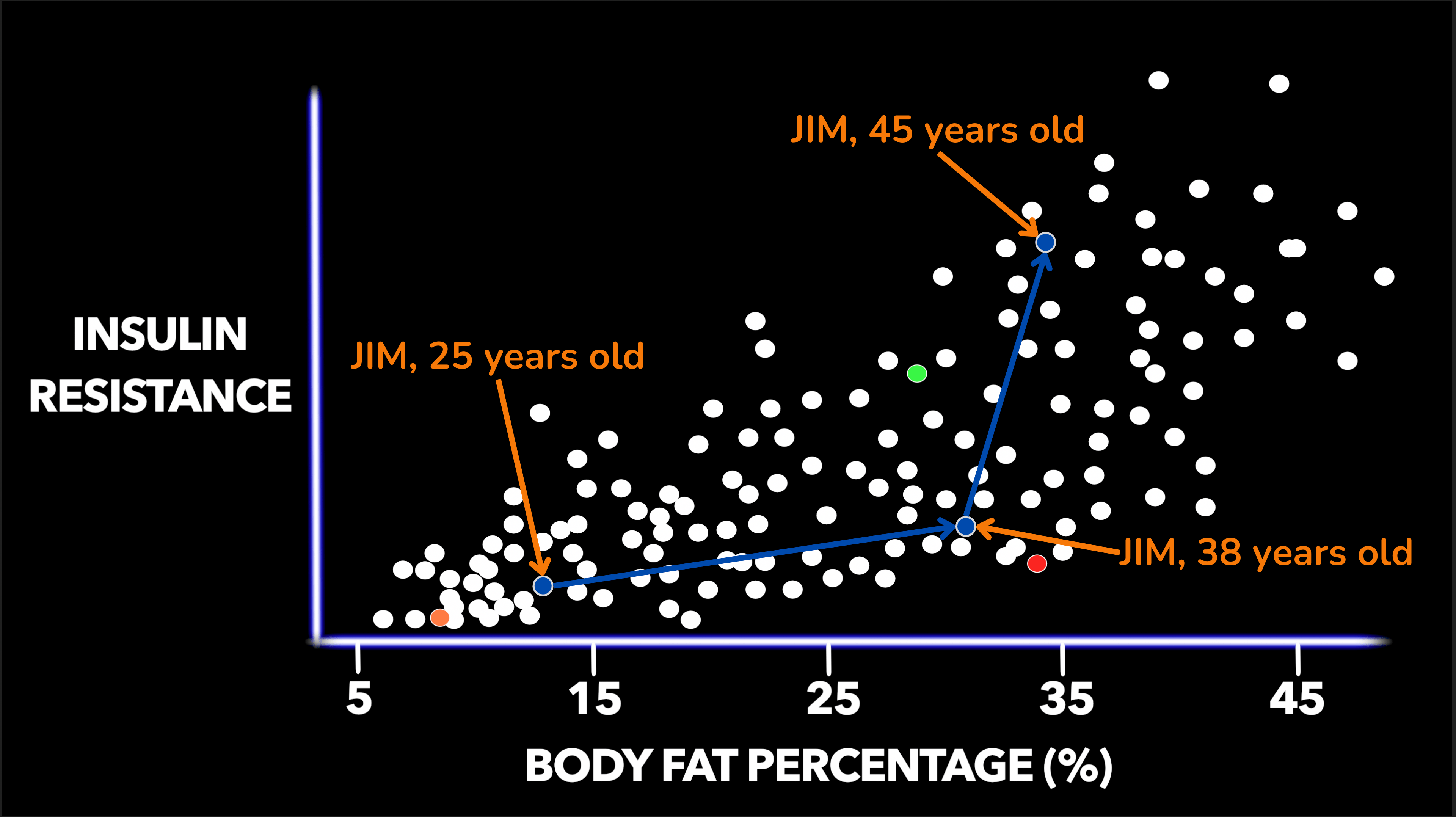
假设有一群男性,我们想要查看下图中 x 轴上的 BMI 和 y 轴上的胰岛素抵抗之间的关系。在正常体重下,BMI 在 20 到 25 之间,大多数人的胰岛素敏感相当好到非常好,或者反过来说,胰岛素抵抗较低。但请注意,这里存在一些变异性,因此即使在完全相同的低体重指数下,有些人比其他人更容易产生胰岛素抵抗。
虚构男性群体中体重指数 (BMI) 与胰岛素抵抗之间的关系
随着体重指数的增加,胰岛素抵抗也随之增加,至少平均而言是这样。在体重指数大于 30 的肥胖人群中,大多数至少有一定程度的胰岛素抵抗,有些则具有很强的胰岛素抵抗。然而,请再次注意,即使体重指数属于肥胖类别,有些人仍然胰岛素敏感。
我想说的第一个重要观点,那就是体重指数有一个主要局限性。请记住,体重指数 (BMI) 计算方法是体重(公斤)除以身高(米)的平方。所以这是衡量体重与身高的关系。然而,这并没有告诉我们为什么任何特定个体的体重会升高。例如,用橙色标记的人是一位非常瘦的健美运动员,相对于他的身高来说,他很重,仅仅是因为有大量的肌肉。与此同时,这个用绿色标记的人的体重指数似乎超重,但肌肉质量很少,体脂率很高,所以这就是为什么他的体重指数水平会有相当大的胰岛素抵抗。
更好的衡量标准是体脂率。那么,让我们将 x 轴从 BMI 更改为体脂率,看看两位男士在图表上的位置如何变化。播放下面的短视频,看看身着橙色衣服的健美运动员,体重指数很高,但体脂率却很低,他是如何向左移动了不少,现在不再是异常值了。事实上,可以预测体脂率如此低的人具有良好的胰岛素敏感性。绿衣肌肉不足、超重的男人现在正在向右移动,因为尽管体重指数不是那么高,但他的体脂率很高,这与他现在的高水平胰岛素抵抗非常一致。
我希望您能理解的是,与体重指数相比,体脂率与胰岛素抵抗的关系更为密切。因此,一般来说,体脂率较低的瘦子通常具有较低的胰岛素抵抗。体脂率较高的人(在超重或肥胖的人中很常见)往往更容易产生胰岛素抵抗。因此,也许并不出人意料的是,身材苗条且对胰岛素敏感的人如果体重增加,往往会变得更加胰岛素抵抗。减肥通常会降低胰岛素抵抗。
一些额外的要点:
首先,我提到这张图表是基于男性的。这种联系对于女性来说非常相似。之所以分开讨论男性和女性,是因为在相同的 BMI 水平下,女性的体脂率更高,因此分开查看这些图表很重要。
其次,可以看到,在任何给定的体脂率水平下,胰岛素抵抗仍然存在广泛的差异。造成这种情况的一个潜在原因是,还有许多与体脂无关的其他原因也会导致胰岛素抵抗。将在以后博客文章中更详细地讨论,例如,某些医疗状况或药物可能会导致胰岛素抵抗。
第三,即使从一个人群中创建了这张图表,其中排除了任何因其他疾病、药物摄入、慢性压力等而产生胰岛素抵抗的人,在任何给定的体脂率水平上仍然存在变异。其原因是人们将脂肪储存在不同的地方,而多余脂肪储存的地方对胰岛素敏感非常重要。
让我来解释。
**脂肪如何安全储存在体内**
为了理解这一点,需要看看脂肪如何安全储存在体内。
考虑一下下面视频中用红色标记的男士,马克。20 多岁的马克是一个非常瘦弱、运动能力强的年轻人,但后来他受伤了,开始了忙碌的职业生涯,经常出差,有了几个孩子。我们都知道这是怎么回事:没有足够的时间睡觉、定期锻炼或烹饪饭菜。他在路上经常去快餐店吃饭,在接下来的20年里,他体重增加了40斤。播放这个视频,看看他的体脂量和胰岛素抵抗在这段时间如何变化。
就他而言,体脂增加了 40 斤,但仍然对胰岛素非常敏感。这是因为他的身体能够将多余的脂肪安全地储存在皮下脂肪组织中。那是皮下、遍布全身的脂肪组织。因此,预计 45 岁的马克的手、手臂、脸部以及任何地方的皮下脂肪库中都会储存更多的脂肪,尤其是腹部和大腿外侧的皮下脂肪库。 。如果他对腹部中部(比如肚脐周围)进行核磁共振扫描,下图显示了这可能是什么样子。
通过磁共振成像 (MRI) 测量马克 45 岁时的内脏和皮下脂肪量。
在这张 MRI 扫描图像中,脂肪是白色的,骨骼、肌肉和内脏是灰色的。外面的脂肪,就在他的皮肤下面,就是所说的皮下脂肪。腹部深处的脂肪,包围内脏,就是所说的腹内脂肪或内脏脂肪
很容易看到,马克的大部分腹部脂肪都储存在外面。皮下脂肪很多,内脏脂肪很少。实际上,在这张图片中看不到他的大部分身体脂肪,因为那甚至不是储存在他的腹部周围,而是储存在他的大腿、小腿、手臂、肩膀等的皮下脂肪组织中。
现在,如果马克能够增加这么多的身体脂肪而几乎不会变得更加胰岛素抵抗,那么为什么体脂量与胰岛素抵抗如此密切相关呢?
**引发胰岛素抵抗的体脂类型**
好吧,让我们看一下会引发胰岛素抵抗的身体脂肪类型。
出于这些目的,看另一个例子:吉姆,在下面的视频中用蓝色标记。和马克一样,他在 20 多岁的时候就非常瘦,运动能力也很强,而且和马克一样,他在接下来的 20 年里也增加了 40 斤的体脂量。所以在 40 多岁时,吉姆和马克的体脂率完全相同。但是,马克仍然胰岛素相当敏感,吉姆现在却胰岛素非常抵抗。这里发生了什么?
看一下吉姆腹部的核磁共振图像。吉姆的皮下脂肪组织中也储存了大量的脂肪,但他的内脏器官周围的内脏脂肪库中也储存了更多的脂肪。事实上,如果量化的话,他的脂肪含量是马克的三倍半,尽管两人的总脂肪百分比相同。这意味着吉姆身体周围皮下脂肪库中储存的脂肪总体百分比较低。例如,他的大腿可能看起来仍然很瘦。
马克和吉姆肚脐区域内脏脂肪量与皮下脂肪量的比较,两人均为 45 岁,全身脂肪百分比相同。
从外表上看,这两个人储存脂肪的差异已经很明显了。马克的体型会更像梨形,因为他大量多余的脂肪储存在身体下部的皮下脂肪组织中,特别是臀部和大腿。相比之下,吉姆的形状更类似于苹果,因为他将大部分多余的脂肪储存在腹部,特别是腹部深处的内脏脂肪库中。
将脂肪储存在内脏脂肪库中通常会导致身体更像苹果,而将脂肪储存在皮下脂肪库中则会导致储存在臀部和大腿,从而形成代谢更健康的梨形身材。
现在,为什么将脂肪储存在内脏脂肪库中会引发胰岛素抵抗,而将脂肪储存在皮下脂肪库中则不会?
出现的这种情况,得到了动物和人类实验中不同证据的支持,表明内脏脂肪并不是真正导致胰岛素抵抗的原因,至少不是内脏脂肪本身造成的。相反,看起来内脏脂肪多,表明皮下脂肪组织已满,无法再储存更多的脂肪。一旦脂肪不再能够安全地储存在皮下脂肪库中,一系列因素就会发生变化,从而导致胰岛素抵抗。
现在这意味着什么:皮下脂肪组织已满,无法再储存更多的脂肪?
**脂肪组织如何运作**
下面谈谈脂肪组织如何运作的基础知识,以及如何与现在被称为个人脂肪阈值假设的联系。
假设有一台非常好的显微镜,能够观察像吉姆这样的人的皮下脂肪组织的变化,因为他在 20 年内增加了 40 斤的脂肪量。
因此,我们在吉姆 25 岁时开始了这一旅程。他的体脂率相当低,胰岛素非常敏感。看他此时的皮下脂肪组织,是由很多脂肪细胞组成的,大多都很小。现在说的小,实际上是不正确的。脂肪细胞是人体中最大的细胞之一,所以当说小时,仍然比大多数其他细胞类型大很多倍。但是,就脂肪细胞而言,年轻的吉姆体内的脂肪细胞很小。在下面的漫画中看到的是,这些脂肪细胞大部分由脂肪滴填充。里面是甘油三酯,与黄油或橄榄油中的脂肪类型相同。那是脂肪和能量在人体内的长期储存形式。
脂肪组织也包含许多其他细胞类型。我不想在这里讨论太多不必要的细节,但强调两种类型。一种是内皮细胞,构成小血管,为脂肪细胞提供营养和氧气。我在漫画中画成了红色。另一种是蓝色的,称为前脂肪细胞。正如之前所说,所以前脂肪细胞可以想象就像等待中的脂肪细胞。还没有准备好储存脂肪,但如果有需要就会变成成熟的脂肪细胞,目前只是闲着。
如果能够在吉姆一生中典型的一天中观察这一点(参见上面的漫画),会看到在禁食状态下,例如睡觉时,脂肪细胞会释放出一小滴所拥有的脂肪存储。释放的是单个脂肪酸,然后漂浮在血液中,为全身组织提供能量。当吉姆进餐时,情况就会发生变化。餐后,他的血液中葡萄糖、脂肪酸和胰岛素的水平都很高,然后营养物质的流动就会发生变化。在胰岛素升高(胰岛素是漫画中的小红色三角形)的影响下,脂肪细胞以三种关键方式发生变化:其一,阻止细胞释放脂肪酸。这有道理,对吧?胰岛素是食物刚刚被摄入的信号,意味着组织可以从食物中获取营养。由于脂肪细胞不再需要为体内其他细胞提供能量,因此胰岛素会阻止脂肪细胞中储存的脂肪分解和释放。
胰岛素还使细胞能够从血液中吸收葡萄糖和脂肪酸。然后葡萄糖转化为脂肪酸,以甘油三酯的形式储存。
因此,请记住这一点:胰岛素与脂肪细胞的结合以及脂肪细胞对其做出反应,不仅是清除血液中葡萄糖的关键过程,而且也是使脂肪细胞能够吸收和储存脂肪的关键过程。这个过程是脂肪细胞在饭后立即储存脂肪,然后在禁食时再次释放脂肪的过程,这一过程在一天中会发生几次。如果摄入的热量与燃烧的热量一样多,那么随着时间的推移,体内储存的脂肪总量就会保持大致相同,全天只有很小的上下波动。
然而,吉姆的情况并非如此。他正在积极增加体重。如下图所示,到了38岁的时候,他的体脂率已经增加了不少,这意味着这些年来,他需要在脂肪组织中储存越来越多的脂肪。现在可以意识到,尽管吉姆增加了相当多的脂肪,但他的胰岛素抵抗并没有发生太大变化。这是因为他能够将额外的脂肪主要储存在皮下脂肪组织中,皮下脂肪组织通过招募新的前脂肪细胞使其变成成熟的脂肪细胞而扩张。也就是说,他的皮下脂肪组织中的脂肪细胞数量增加了。但他的脂肪细胞大小并没有增加。他现在有更多的小脂肪细胞,这种细胞数量的增加为增生。通常,当皮下脂肪组织能够通过增生而扩张时,胰岛素敏感不会发生太大变化。因此,如果在吉姆 38 岁时再进行一次 MRI 扫描,预计他会有更多的皮下脂肪,但内脏脂肪不会更多。
吉姆的体脂率和胰岛素抵抗的变化
但皮下脂肪组织不能通过增生永远扩张,因为该组织可招募的前脂肪细胞数量有限。似乎很明显,老年人招募新前脂肪细胞的能力更加有限。这是因为随着年龄的增长,似乎会部分失去制造新的前脂肪细胞所需的干细胞。皮下脂肪组织增生的程度可能也与遗传因素有关。
无论出于何种原因,能够招募的小脂肪细胞数量都是有限的。吉姆大约在 38 岁时就达到了这个极限。在接下来的几个月里,随着他的身体脂率持续增加,皮下脂肪细胞的大小开始扩大。那是因为他的皮下脂肪无法招募更多新的脂肪细胞,所以现有脂肪细胞需要储存更多。这个过程现在称之为肥大。吉姆现在的脂肪细胞比年轻时更多了,而且所有这些脂肪细胞现在也逐渐变得越来越大。这会带来一些负面后果。
其一,变得太大的脂肪细胞会越来越远离提供营养和氧气的血管。细胞和组织作为一个整体的扩张会产生缺乏足够氧气的细胞袋,称之为缺氧。体积太大且无法获得足够的氧气会产生一种威胁单个细胞生存的状态,实际上,有些细胞会死亡。结果,健康细胞之间突然出现了脂肪团和细胞碎片。不需要成为一名细胞生物学家就能明白这不是一件健康的事情。
其二,脂肪细胞变得太大,并且缺乏氧气,需要帮助。通过分泌信使分子来吸引血流中的某些其他细胞来做到这一点。一种称为单核细胞的特定类型的白细胞是最先做出反应的细胞之一,这些单核细胞从血液移动到脂肪组织中。在组织中,单核细胞转变为称为巨噬细胞的特殊细胞,为任何任务做好准备。这些巨噬细胞是一种非常神奇的细胞,它们得到的信息是巨大的脂肪细胞被压垮了,它们还看到周围有来自死亡细胞的脂肪和组织碎片。所以它们做了很多事情。它们清理死亡脂肪细胞中的混乱。它们还有助于建立新血管,确保扩张的脂肪组织内的所有细胞都能获得足够的营养和氧气。它们还分泌炎症介质。这些介质,称之为细胞因子,可以帮助非常大的脂肪细胞——产生胰岛素抵抗。现在,通常情况下,炎症细胞因子会引起组织中的胰岛素抵抗,因为它们想要为自己保留稳定的葡萄糖供应,因为它们通常会对抗该组织中的感染。通过使周围的组织细胞产生胰岛素抵抗,这些细胞停止从血液中吸收葡萄糖,并且更多的葡萄糖可供对抗入侵病原体的免疫细胞使用。
那么炎症细胞因子在脂肪组织中的作用是什么呢?在这里,触发炎症细胞因子的释放及其使脂肪细胞产生胰岛素抵抗的作用也是有意义的。因为想象一下这些超级大的脂肪细胞太大了,几乎无法生存。如果必须从循环中吸收更多的葡萄糖或脂肪酸,就会破裂(或多或少是字面意义上的)。通过产生胰岛素抵抗,它们的生长基本上停止。因为如果现在餐后糖和脂肪酸与胰岛素一起进入,胰岛素就不再能够有效地将糖和脂肪酸输送到大脂肪细胞中。而且在禁食状态下,胰岛素抑制脂肪细胞释放脂肪酸的能力也较差。因此,大脂肪细胞继续将脂肪酸分泌到血液中,而不是从血液中吸收糖和脂肪酸。在这个小格局中,特别是对于巨大的脂肪细胞来说,这是一个胜利,因为可以防止脂肪细胞死亡。但是,您可能猜到,这是有代价的。
其一,皮下脂肪组织现在存在胰岛素抵抗。因为皮下脂肪组织是一个可以去除餐后血液中糖分的地方,所以这并不是一件好事。基本上就像有不同组织的团队一起工作,以始终将血糖保持在正常范围内,通过使皮下脂肪组织产生胰岛素抵抗,只是一名球员。
但更大的问题是血液中的葡萄糖和脂肪现在需要转移到其他地方。它们去哪里:它们储存在内脏脂肪库中,也储存在肌肉和内脏器官中,例如肝脏和胰腺。因此,随着内脏库中的脂肪含量增加,以及肝脏和肌肉中的脂肪含量增加,整体胰岛素抵抗也会增加。思考这个问题的一种方法是用毒性。肝脏和肌肉中的细胞,以及皮下和内脏脂肪组织中的细胞是餐后吸收葡萄糖的主要细胞类型。现在,它们已经越来越多地充满了糖和脂肪。就像吃了几块蛋糕就吃饱了,无法再吃更多一样,肝细胞、肌肉细胞和脂肪细胞越来越多地说:够了!它们降低了对胰岛素的敏感性。对胰岛素敏感性较低就是所说的胰岛素抵抗。
现在,正如我们反复讨论的那样,胰岛素抵抗不会自动导致葡萄糖不耐受。在一段时间内,身体可以简单地产生更多的胰岛素。然而,我刚才提到,当皮下脂肪组织充满时,脂肪也会积聚在胰腺中。现在人们还认为这种胰腺脂肪会降低胰腺β细胞产生胰岛素的能力。我们将在另一篇博客文章中讨论这一点。
我之前提到过“个人脂肪阈值”这个词。这意味着什么?个人脂肪阈值是可以安全地储存在皮下脂肪组织内的小脂肪细胞中的脂肪量。
所以,对于吉姆来说,他的个人脂肪阈值大约是在38岁左右的时候,因为可以清楚地看到,超过这个点,即使是需要储存的少量额外脂肪也会引发胰岛素抵抗的大幅增加,从现在开始,越来越多的额外脂肪需要储存在不安全的地方。我们称这些不安全的地方为异位脂肪仓库,异位意味着不典型或不是为此目的而制造的。传统上,将储存在肝脏、肌肉和胰腺中的脂肪称为异位脂肪,因为这些不是脂肪储存组织。然而,我和一些同事也将内脏脂肪库称为异位,因为为了最佳健康,确实不应该在内脏储存大量脂肪。所以当吉姆 45 岁的时候有胰岛素抵抗,因为他的内脏脂肪库中储存了相当多的脂肪,他的肝脏和肌肉中有多余的脂肪,而且身体组织中有低度慢性炎症,但也可以在血液中测量。稍后再讨论这个问题。
马克和吉姆之间脂肪储存的差异
因为这是非常重要的一点,所以让我们再次明确一点,吉姆的身体如何储存多余的脂肪,与前面的例子马克形成鲜明对比。请记住,在进行上图中的 MRI 扫描时,吉姆和马克都在 40 多岁,体脂率相同。最大的区别是马克很幸运,他能够将大部分体脂储存在皮下脂肪库中。他的内脏、肝脏和肌肉中并没有储存太多脂肪,而且因为他的皮下脂肪尚未被压垮,所以他的脂肪组织也没有低度慢性炎症。因此,他仍然对胰岛素相当敏感。
现在,不要忘记我在这里选择了两个极端的例子,但确实很好地说明了体脂的增加本身并不会引发胰岛素抵抗的增加,尽管体脂率与胰岛素抵抗有关。这是因为只有某些类型的体脂,即储存在内脏和异位脂肪库中的脂肪,会导致胰岛素抵抗,而储存在皮下脂肪库中的脂肪则不会。思考体脂率与胰岛素抵抗之间关系的一种方法是,随着体脂率的增加,任何特定个体越来越有可能超过其个人脂肪阈值,开始在内脏和异位储存中积累脂肪。
**支持个人脂肪阈值假说的证据是什么?**
到目前为止,我已经概述了从皮下脂肪组织储存脂肪失败,到内脏和异位脂肪储存,再到全身胰岛素抵抗的一系列事件。支持这个模型的实际证据是什么?具体来说,如何知道会发生这种情况,为什么没有其他解释可以解释脂肪量过多的人往往更容易产生胰岛素抵抗?
科学上几乎不可能有 100% 确定性。总有其他解释,作为科学家,应该对新想法和新数据保持开放的态度,事实上,当进食和体重增加时,很可能会发生其他可能导致胰岛素抵抗的因素。我们将在以后的博客文章中讨论这些附加因素。在我和许多同事看来,我在这里概述的模型是与累积证据最一致的模型。因此,让我分享更多支持这个模型的证据,这些证据让我相当确信个人脂肪阈值假设是有价值的。
支持个人脂肪阈值假说的一个关键证据就是刚才讨论的:对胰岛素敏感的肥胖者往往在皮下脂肪库中储存更多的脂肪,内脏脂肪、肝脏和肌肉中的脂肪往往较少,并且炎症水平低。相比之下,那些胰岛素抵抗最严重的人,内脏储存的脂肪要多得多,往往患有非酒精性脂肪肝(NALFD),意味着肝脏中储存了过多的脂肪;肌肉组织中往往含有脂肪,并且身体组织和血液中往往含有高水平的炎症标记物。几年前,我们在一篇综合评论文章中总结了有关该主题的大量文献。
另一项研究强烈表明,将脂肪储存在皮下脂肪库,而不是内脏脂肪库甚至肝脏和肌肉中,具有特殊的好处。这是对一种叫做脂肪营养不良疾病的研究。脂肪营养不良可以是遗传性的,也可以是后天性的,例如,某些因感染艾滋病毒而服用抗逆转录病毒药物的人。其共同点是,在所有情况下,皮下脂肪组织或多或少都无法募集前脂肪细胞来安全地储存脂肪,所以这些人往往胳膊和腿都很细,皮下脂肪组织很少,大部分体脂储存在内脏库以及肝脏和肌肉中。临床上这种情况通常伴有或多或少明显的胰岛素抵抗,通常表现为 2 型糖尿病。
在经过基因改造患有脂肪营养不良的小鼠中,看到了同样的情况:皮下脂肪组织的缺乏导致脂肪在异位储存库中积聚,产生通常严重的胰岛素抵抗。然后,如果将一些功能性皮下脂肪组织移植上去,整个状况,包括胰岛素抵抗,在某种程度上是可逆的。
一些 调查还研究了抑制因超过个人脂肪阈值而产生的脂肪组织(也可能是肝脏、甚至肌肉)炎症的效果。一般来说,这些研究表明,当炎症途径受到抑制时,即使体脂量或脂肪分布没有改变,胰岛素敏感也会适度改善。这表明炎症在胰岛素抵抗和脂肪量增加的发展中起着因果作用。在这些研究中,胰岛素敏感仅略有改善,并未完全正常化,这也表明,低度慢性炎症只是超过个人脂肪阈值的个体胰岛素抵抗的部分原因。尽管这些数据听起来很有希望,我承认我对治疗胰岛素抵抗和 2 型糖尿病的抗炎方法有点怀疑,因为我认为免疫系统的作用和炎症途径的激活在被营养过剩淹没的组织中具有保护作用。如果没有适当的免疫反应,皮下脂肪组织中的更多细胞可能会死亡,从长远来看,情况可能会更糟。因此,尽管发表了一些小规模的抗炎试验,但没有治疗 2 型糖尿病的抗炎药物,这也许并不奇怪。
支持个人脂肪阈值假说的最后一个主要证据来自减肥研究。每当人们减肥时,胰岛素敏感往往会提高,但发现肝脏脂肪、肌肉脂肪和内脏脂肪下降最多的人改善最大。这再次有力地支持了这样的观点:在这些部位中储存脂肪会极大地导致胰岛素抵抗。
**为什么个人脂肪阈值假设具有相关性?**
一旦某人体脂无法安全地储存在皮下脂肪组织的小脂肪细胞中,就会出现许多健康风险。正如在此讨论的,内脏脂肪库以及肝脏和肌肉中的脂肪储存几乎肯定是胰岛素抵抗的一个关键因素,也是体重指数高的人患 2型糖尿病的风险大幅升高的一个主要原因。
不过,由于其他原因,在异位储存库中储存大量脂肪也是不好的。
先来看看肝脏。肝脏中储存大量脂肪被称为非酒精性脂肪肝,简称NAFLD,是肝纤维化和肝硬化的危险因素。肝硬化本身就是一种非常糟糕的疾病。然而,肝硬化也会大大增加患肝癌的风险。而且,鲜为人知的是,NAFLD 也是心血管疾病发展的主要危险因素。
然后是心脏。现在人们认识到,在内脏脂肪库(心脏周围的心外膜脂肪库)中储存过量的脂肪是冠心病的危险因素。虽然这种关系背后的机制尚不完全清楚,但如果心外膜脂肪组织中存在慢性低度炎症情况可能尤其如此。
同样,胃肠道周围的内脏脂肪组织(称为肠系膜脂肪)被认为在消化系统癌症(尤其是结肠癌)中发挥作用。
最后,我们确实知道内脏脂肪的扩张和内脏脂肪的炎症与肾功能下降 有关。
因此,总而言之,有充分的理由努力保持在个人脂肪阈值以下。我确实认为了解这个假设是有用的,因为这表明体重增加对健康的负面影响不会以线性方式扩展。在超过个人脂肪阈值之前,大多数人可能会增加相当多的体重。我并不是想鼓励增重,知道并非一生中每增加一斤体重都必然会对健康产生负面影响,这可能会有所帮助。即使超重或肥胖,现有数据确实表明,如果减自肝脏和内脏脂肪库,仅减掉几斤额外的体重就可以带来重大的健康益处。从前面的例子来看,吉姆只需要减掉几斤额外的脂肪,胰岛素敏感就会明显提高。他不需要一下子回到20多岁时的体重。
**如何知道是否跨越了自己的个人脂肪阈值?**
很多人现在都想知道:如何知道自己是否已经跨越了个人脂肪阈值?
最好的方法是进行腹部核磁共振扫描,直接测量内脏脂肪量和肝脏脂肪。这在临床护理中并不常规进行,但如果确实需要知道,当然可以自己支付扫描费用。就我个人而言,我认为这对于大多数人来说是没有必要的。
因此,除非有几千元的闲钱,否则使用一些间接措施将是更好的选择。
一种选择是通过 DEXA 扫描估算内脏脂肪量。DEXA 扫描通常用于测量骨矿物质密度,但该系统通常还可以提供相当好的全身脂肪量测量和内脏脂肪估计,至少对于较新的 DEXA 扫描仪型号是这样。
肝脏脂肪也可以通过特定的超声方法来估计。
另一种选择是将 BMI 与胰岛素抵抗指标(例如我在上一篇博文中讨论过的 HOMA-IR) 、炎症指标(例如 C 反应蛋白 (CRP))和空腹血甘油三酯一起考虑。
如果BMI 升高、HOMA-IR 升高、CRP 升高以及空腹甘油三酯升高,则身体可能内脏脂肪和异位脂肪库增加。对于CRP来说,做高敏CRP检测很重要,普通的不够灵敏。
请注意,对于大多数内脏脂肪和异位脂肪过多的人来说,大多数或所有这些标记物都会至少略有升高。因此,寻找这些标记中至少 2 或 3 个的一致升高,而不是单个升高。记住这一点尤其重要,因为除了过多的内脏脂肪和异位脂肪之外,这些标记物可能会因其他原因而升高。例如,患有重病或刚刚接受过大手术的人的 CRP 可能会大幅升高。这不是这里要找的。相反,我们感兴趣的是检测脂肪组织或肝脏中因营养过剩而导致的慢性低度炎症。因此,在空腹状态下抽血进行这些检测很重要,
建议的内脏和异位脂肪储存过多的替代指标:大多数内脏和异位脂肪储存过多的个体体重指数 (BMI) 升高,HOMA-IR、hsCRP 和空腹甘油三酯指标至少轻微升高 2-3 个。
此外,上表中显示的这些临界值是我的估计,显然是基于科学文献,但并不是牢固确立的临床临界值,因此请使用这些值来粗略地了解自己的可能性有多大。可能有内脏脂肪和异位脂肪升高。不要自我诊断,确保与医生讨论这个问题。我个人确实认为这些措施在没有直接测量(例如 MRI 扫描)的情况下仍然有价值,因为这些都与内脏和异位脂肪沉积的增加密切相关。如果试图减掉异位脂肪和内脏脂肪,这些检测指标也可以用来跟踪进展,不用为重复的 MRI 扫描自掏腰包。
**个人脂肪阈值假说总结**
总结一下 个人脂肪阈值假设:
BMI 体重指数,尤其是体脂率,与胰岛素抵抗相关。
然而,在任何特定的肥胖水平下,胰岛素抵抗都存在很大的差异。
这是因为并非所有体脂都会导致胰岛素抵抗。事实上,将脂肪安全地储存在皮下脂肪库的小脂肪细胞中可以在一定程度上防止胰岛素抵抗。
胰岛素抵抗主要在超过个人脂肪阈值后出现。达到该阈值时,人的皮下脂肪组织不再通过招募新的脂肪细胞(增生)来扩张,而是通过现有脂肪细胞的生长来扩张(肥大)。
脂肪细胞肥大导致皮下脂肪细胞炎症和胰岛素抵抗。
皮下脂肪细胞中的胰岛素抵抗降低了身体安全储存脂肪的能力,逐渐需要将更多的脂肪储存在异位位置,例如内脏、肌肉、肝脏和胰腺周围的内脏脂肪库。这些储存库中过多的脂肪储存也会导致这些组织的炎症和胰岛素抵抗。
最终的结果是全身胰岛素抵抗,因为通常在富含碳水的餐后吸收葡萄糖的所有组织都已经充满了营养。换句话说,这些组织完成其工作和参与正常血糖调节的能力因所谓的能量毒性而受到损害。
在接下来的文章中,讨论胰岛素抵抗的其他原因和提高胰岛素敏感的不同方法时,对个人脂肪阈值假说有深入的了解将非常有用。请留言发表评论以提供反馈或提出任何问题。
好好关心自己。
**参考**
- 科尔迪茨等人;体重增加是女性临床糖尿病的危险因素。内科年鉴1995;122:481-6。
- 亚古特卡等人;肥胖和糖尿病风险的种族差异——基因研究的见解。内科杂志2020; 288:271-83。
- 布尔汉斯等人;脂肪组织炎症对 2 型糖尿病发展的贡献。综合生理学2018;9:1-58。
- 福斯-弗雷塔斯等人;脂肪营养不良的诊断策略和临床管理。2020 年内分泌学和代谢学专家评论;15:95-114。
- 帕特尼和加尔格。糖尿病专家的脂肪营养不良 - 寻找什么。当前糖尿病报告 2022;22:461-70。
- 勒莱等人;脂肪不足:遗传性脂肪营养不良的小鼠模型。内分泌学前沿 2022;13:785819。
- 王等人;脂肪组织移植可改善 seipin 缺陷小鼠的脂肪营养不良相关代谢紊乱。美国生理学杂志 - 内分泌学和代谢 2019;316:E54-62。
- 戈德芬等人;2 型糖尿病患者的水杨酸盐(双水杨酸盐):一项随机对照试验。内科年鉴2013;159:1-12。
- 卡拉蒂等人;糖皮质激素激活抗炎巨噬细胞可防止胰岛素抵抗。自然通讯2023;14:2271。
- 马科斯等人;中度和随后的渐进性减肥对肥胖症患者代谢功能和脂肪组织生物学的影响。细胞代谢2016; 23:591-601。
- 舒贝尔等人;与没有 NAFLD 的个体相比,类似的体重减轻会导致 NAFLD 个体的胰岛素敏感性和肝功能有更大的改善。2019年营养素;11:544。
- 古德帕斯特等人;减肥对肥胖患者局部脂肪分布和胰岛素敏感性的影响。糖尿病 1999;48:839-47。
- 伯恩和塔格。NAFLD:一种多系统疾病。肝病杂志2015; 62:S47-64。
- 品特等人;癌症和肝硬化:对预后和治疗的影响。2016 年 ESMO 公开赛;1:e000042。
- 杜尔等人;非酒精性脂肪肝和心血管风险:美国心脏协会的科学声明。动脉硬化血栓形成与血管生物学 2022;42:e168-85。
- 弗雷扎等人;肥胖对患结肠癌风险的影响。肠道2006;55:285-91。
- 卓别林等人;**结直肠癌与肥胖关系背后的见解:内脏脂肪组织是缺失的一环吗?**国际分子科学杂志 2022;23:13128。
- 真锅等人;**内脏脂肪面积对慢性肾脏病患者的影响。**临床和实验肾病学 2021;25:608-20。
- Mueller-Peltzer 等人;脂肪组织与肾功能参数相关。2023 年科学报告;13:9151。
- 德克斯等人;内脏脂肪和肝脏脂肪对慢性肾脏病相关肾脏结果的单独贡献。肾脏营养杂志2020;30:286-95。
https://nourishedbyscience.com/personal-fat-threshold/
</markdown>
D:2023.10.11<markdown>
**胰岛素抵抗:主要原因和影响因素**
2023 年 10 月 12 日
胰岛素抵抗是导致 2 型糖尿病、心脏病、中风和癌症等毁灭性慢性疾病的关键危险因素。
这是个坏消息,因为现在许多国家的大多数成年人口都被认为有胰岛素抵抗。
例如在美国,大约 50% 的成年人口(大约 1.33 亿人)患有糖尿病或糖前期,就能意识到这个问题。而造成这种流行病的主要因素显然是胰岛素抵抗。即使只考虑那些没有明显糖尿病的相对年轻(18 至 44 岁)的成年人,胰岛素抵抗(由 HOMA-IR 定义为 2.5 或更高)的患病率仍然为 40%。我还没有看到全世界胰岛素抵抗比率的估计,但考虑到全世界有 5.37 亿成年人患有明显糖尿病,另有 5.41 亿成年人有糖前期,可以理解这一问题的严重性。
到底是什么导致胰岛素抵抗?胰岛素抵抗有很多不同的触发因素,但我试图归纳为 16 个最常见的触发因素。在本文中,我将简要介绍每个原因,将在以后的博文中进行更详细的讨论,将讨论如何解决这些特定原因以逆转胰岛素抵抗。
我建议可以使用本文中的信息的方式是,如果您还没有胰岛素抵抗,那么本文教您在未来需要注意什么,最好避免什么,以确保能保持胰岛素敏感。
但如果您知道或怀疑自己有胰岛素抵抗,那么可以阅读本文,尝试找出哪些触发因素可能是导致自己胰岛素抵抗的原因。如果本文给您一些想法,我建议您与医生进一步讨论。
顺便说一句,如果您不确定胰岛素在体内的作用,以及胰岛素抵抗是什么,我强烈建议您首先阅读这篇有关血糖调节基础知识的文章《》。
下面是胰岛素抵抗的原因。
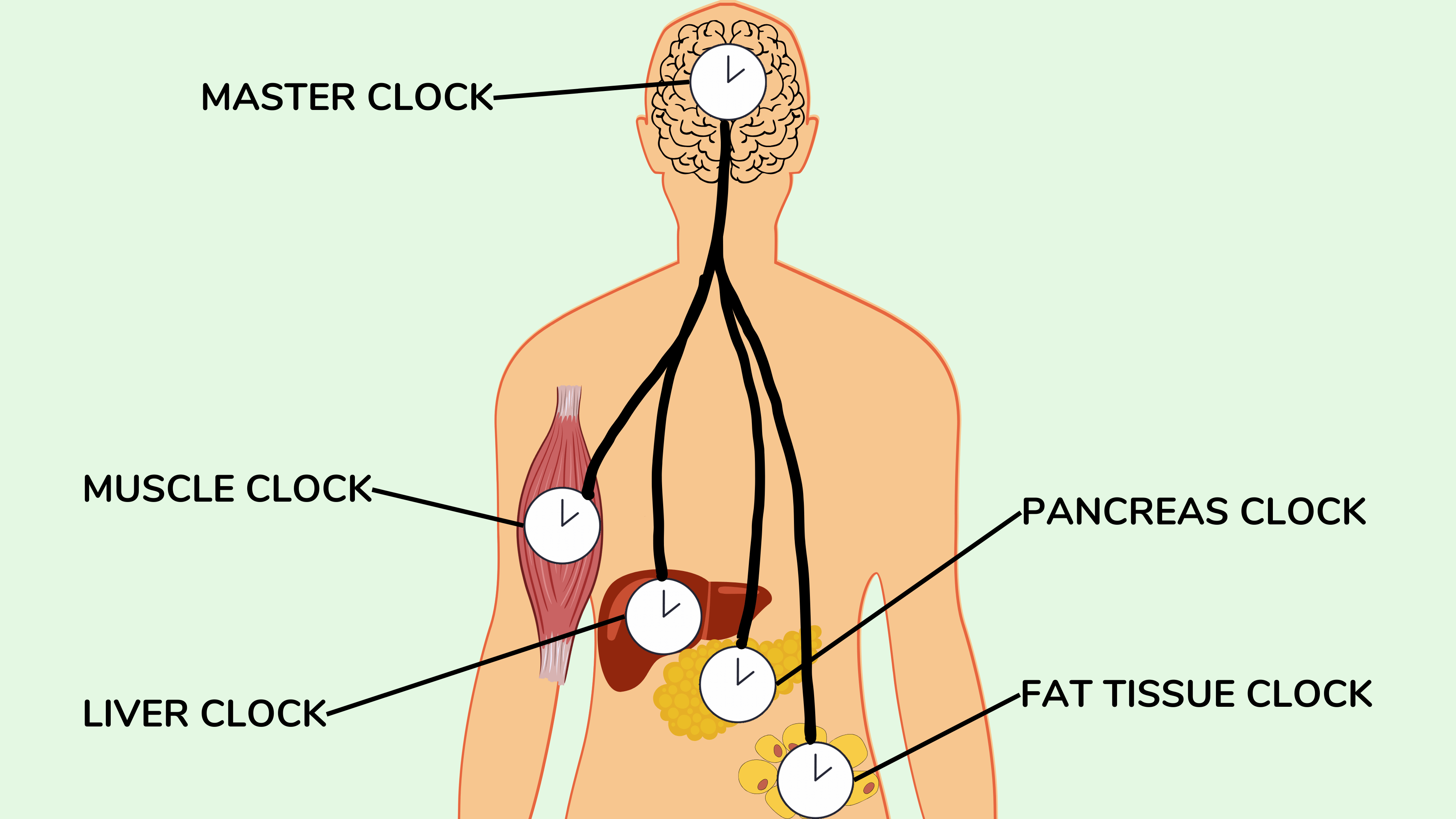
**1.内脏脂肪和异位脂肪**
有大量证据表明胰岛素抵抗与内脏脂肪和异位脂肪的积累有关。内脏脂肪也称为腹内脂肪,由腹腔内的多个脂肪库组成,包围内部器官。异位脂肪是沉积在肌肉和不适合储存脂肪的内部器官(例如肝脏)内的脂肪。在下图中,我们可以清楚地看到,尽管马克和吉姆这两个男人的总体脂率相同,但吉姆的内脏脂肪很多,而马克的内脏脂肪很少。这里看不到异位脂肪,但通常,如果一个人有更多的内脏脂肪,也往往有更多的异位脂肪。导致内脏和异位脂肪堆积的因素有很多,但可能最重要的一个因素是体脂的主要储存部位,即皮肤下方的皮下脂肪组织,已满负荷运转,无法储存脂肪。时间越长,储存的脂肪就越多。因此,在此示例中,吉姆预计比马克具有更强的胰岛素抵抗。
内脏脂肪与腹部皮下脂肪及其与胰岛素抵抗的关系
有关皮下脂肪库中健康脂肪储存与导致胰岛素抵抗的内脏脂肪和异位脂肪沉积之间关系的更多详细信息,请查看我就此主题撰写的专门文章《》。
这里的结论是,如果想对胰岛素敏感,则需要尽量减少内脏和异位脂肪库中的脂肪量。
**2.慢性高胰岛素血症**
确实有证据表明慢性高胰岛素血症会导致胰岛素抵抗。正如我在上一篇文章《》中更详细讨论的那样,正如我们在称为高胰岛素钳夹的临床手术中、或在患有称为胰岛素瘤的胰腺良性肿瘤的患者中看到的那样,长期升高的胰岛素浓度似乎确实会导致胰岛素抵抗。
我还讨论了,由于摄入富含碳水的饮食而引起的血液胰岛素水平的典型上下波动似乎并非如此,因为没有一致的证据表明,与低碳水饮食相比,高碳水饮食会导致胰岛素抵抗。
然而,一些读者可能想知道,持续吃精制碳水零食或整天喝含糖饮料是否会使胰岛素水平长期升高,以及是否会导致这些人出现胰岛素抵抗。例如,有人以烤面包和果酱早餐开始新的一天,其中早餐是精制谷物,主要是糖。两小时后,他们再次感到饥饿,吃了松饼作为零食,同样是精制谷物和糖。午餐时,吃一个三明治加奶酪和一罐普通汽水,然后是几块巧克力曲奇饼作为下午点心,晚餐是米饭和蔬菜。
这种高升糖饮食,在主餐之间定期吃零食,肯定会使血液胰岛素水平全天保持在基线以上。我不知道这是否会导致胰岛素抵抗。我认为可能会,但是没有良好的人类干预研究来测试这一点。不过,我要说的是,即使有临床试验数据表明这种饮食方式不会导致胰岛素抵抗增加,我仍然会说,经常食用精制谷物和糖,尤其是呈液体形式的糖,肯定不是一个好习惯。而且永远不让身体休息、不断摄入热量也不是一个好主意。
虽然慢性高胰岛素血症会引发胰岛素抵抗,但吃高碳水食物导致的血液胰岛素水平适度上下似乎不会产生这种作用。然而,现有的证据是有限的,因为是间接的(试验比较了碳水化合物和脂肪含量不同的饮食,而不是其每日胰岛素浓度),并没有测试会使血液胰岛素水平长期升高的饮食。
在这个背景下,让我解释一下慢性高胰岛素血症可能诱发胰岛素抵抗的一种机制。在之前的博客文章中,我解释了胰岛素与肌肉细胞中的胰岛素受体结合。这会刺激细胞内的级联反应,产生多种效应,这些效应根据胰岛素所结合的细胞而略有不同。在肌肉细胞中,胰岛素信号导致称为 GLUT-4 的葡萄糖转运蛋白移动到细胞膜,然后血液中的葡萄糖可以通过这些葡萄糖转运蛋白进入细胞。
现在,有几种机制可以使这种细胞产生胰岛素抵抗。一是与胰岛素与胰岛素受体结合后,结合牢固,不能轻易松手有关。因此,细胞将整个复合物吸收到细胞内,然后将其降解,这意味着将蛋白质消化成氨基酸成分,或者将其回收,这意味着受体在细胞的特定部分与胰岛素分离。这很重要,因为这意味着胰岛素与胰岛素受体的结合会暂时减少细胞表面上游离的可用胰岛素受体的数量。细胞表面的胰岛素受体数量需要一段时间才能再次增加到正常水平,这表明在高血糖和高胰岛素膳食后给细胞时间恢复是个好主意。数据支持这一点,显示高胰岛素血症减少了小鼠体内和体外胰岛素靶细胞表面胰岛素受体的数量。
这里的结论是,需要避免胰岛素浓度长期升高。为了安全起见,尽量减少高升糖指数食物的摄入,并在两餐之间给身体几个小时的时间乏食状态是有意义的。
**3. 炎症**
因此,已知体内炎症会直接诱导所有暴露于炎症的细胞中的胰岛素抵抗。为什么会这样呢?
让我们想象一下在做晚餐时不小心割伤了自己。刀上的一些讨厌的细菌会通过伤口进入皮肤。现在,细菌正在攻击皮肤细胞,并有可能进入血液,可以从血液中传播到身体的任何地方。我们需要防止这种情况发生。
幸运的是,身体有防御力量:白细胞,免疫系统的一部分。这些白细胞从血液移动到皮肤中,瞬间细菌和免疫细胞就卷入了一场可怕的战斗。可以从外面看到这一点:几个小时内,皮肤变得温暖、发红,这种免疫细胞的激活就是所说的炎症。
问题是越来越多的细菌进入伤口,免疫细胞变得又累又饿,需要更多的能量,首选的能量来源是葡萄糖。因此,战斗的免疫细胞开始从血液中吸收葡萄糖。问题在于,有时血液中可用的葡萄糖相当少,而有很多饥饿的嘴巴需要喂养,因此进化做了一些非常聪明的事情:白细胞产生某些称为细胞因子的信号分子,告诉其他皮肤细胞有是否有炎症。这些细胞因子的作用之一是使非免疫细胞产生胰岛素抵抗,从而阻止它们吸收葡萄糖。这很有意义:我们正在努力保护身体,而战斗的免疫细胞首先应该得到食物,对吧?
就局部而言,在割伤自己后的组织中,炎症会导致组织中的胰岛素抵抗,这确实很有意义。驻留在该组织中的细胞可以在几个小时内承受少量的葡萄糖,使它们产生胰岛素抵抗,确保战斗的免疫细胞拥有所需的所有能量。而且由于这种炎症仅影响该局部组织,这意味着身体中只有这一小部分具有胰岛素抵抗,而身体的其他部分不受影响。
然而,同样的事情也可能发生在整个身体上。想象一下,患有严重的急性感染,例如流感或肺炎,然后体内更多的免疫细胞处于战斗模式,结果,整个身体将变得有些胰岛素抵抗。或者,如果患有系统性红斑狼疮等自免性疾病,自己的免疫系统正在攻击自己的身体。这也可能导致胰岛素抵抗。或者,如果刚刚做过大手术,炎症标记物通常会上升很多,并且会在几天内对胰岛素产生严重抵抗。或者在最近的一篇博客文章《》中讨论的内容:全身脂肪细胞的低度慢性炎症,这是由于这些脂肪细胞太大和不堪重负的结果。
所有这些的共同点是免疫系统被激活,由此产生的炎症会导致所有与炎症接触的细胞产生胰岛素抵抗。
好消息是,一旦炎症消退,胰岛素敏感将再次恢复正常。
**4. 肌肉质量低**
这是一件很多人不知道的有趣事。即使没有多余的体脂、或多余的内脏脂肪和异位脂肪量,如果肌肉质量较低,也可能会出现胰岛素抵抗。例如,在一项横断面研究中,如果参与者的体脂量低、且肌肉量高,则对胰岛素敏感;如果体脂量升高或肌肉量低,则对胰岛素抵抗。换句话说,低肌肉量和低体脂量与胰岛素抵抗的相关性与高体脂量和高肌肉量的相关性一样。
低肌肉量可能是胰岛素抵抗的一个原因,即使对于体脂量低的人也是如此
这与另一项对 132 名成年人进行的研究一致,其中大多数是年轻人和超重,研究人员测量了胰岛素抵抗和肌肉质量,还测量了体脂量,甚至内脏脂肪量和异位脂肪量。他们发现,即使在对体脂、内脏脂肪和异位脂肪进行统计调整后,肌肉质量最低的人对胰岛素抵抗也最强。
同样,Srikanthan 和 Karlamangla 研究发现,在美国国家健康与营养检查研究 (NHANES) 的 13,644 名参与者中,相对于体型而言,较高的肌肉质量与较好的胰岛素敏感相关。
这里的结论是,最佳的胰岛素敏感性需要高肌肉质量和低体脂量,或者更准确地说,需要低内脏脂肪和异位脂肪。
**5. 缺乏身体活动**
久坐的人更容易产生胰岛素抵抗,这对任何人来说都不奇怪。因为他们会拥有更少的肌肉质量和更多的脂肪质量,这两个已经讨论过的导致胰岛素抵抗的因素吗?是的,这可能是真的,但有趣的是,我们可以检测到缺乏身体活动对胰岛素敏感的重大负面影响,甚至与较低的肌肉量或较高的脂肪量无关。
例如,如果卧床休息,即使只是三天,也会产生相当大的胰岛素抵抗,尽管体重和体脂在此期间几乎没有变化。卧床休息几天后,肌肉质量可能会略有减少,但通常不足以完全解释这种情况下胰岛素抵抗的巨大增加。
在许多其他研究中也观察到了同样的现象。例如,汉堡等人研究发现,20 名健康参与者在卧床休息五天后,胰岛素敏感大幅降低。
即使肌肉量或脂肪量没有变化,卧床休息等身体活动不足也会诱发胰岛素抵抗
Bowden Davies 及其同事对 45 名高度活跃的参与者进行了干预,他们被要求将每日步数减少约 80%,这导致每日静坐时间平均增加 223 分钟。即使仅仅 14 天的活动减少也会导致胰岛素敏感大幅降低,在这种情况下,这与肌肉质量的明显下降和脂肪质量的增加有关。
这些数据意味着,无论身体成分如何,长时间久坐都会产生胰岛素抵抗。即使每周锻炼两次,如果只是坐在办公桌前或沙发上,可能会因为正式锻炼之间的这些不活动时间而变得相当胰岛素抵抗。还值得强调的是,过度不活动有点双重打击:不活动本身会引发胰岛素抵抗,而长期不活动导致的低肌肉质量和较高体脂量会导致额外的胰岛素抵抗。
**6.压力**
在整个进化过程中,压力一直是身体对危险的复杂而协调的反应。因此,假设您是石器时代的人,刚刚吃了一些肉和一些浆果。您的胰岛素水平适度升高,胰岛素将浆果中的糖分和肉类中的脂肪输送到脂肪细胞中进行长期储存。
富含碳水和脂肪的膳食后,胰岛素会协调将葡萄糖和脂肪酸吸收到脂肪细胞中进行长期储存
突然,你看到一只巨大的熊接近你的营地,这会引发通常所说的战斗或逃跑的急性应激反应。身体会分泌多种激素,尤其是皮质醇和肾上腺素。这两种激素的作用之一是使身体组织立即产生 胰岛素抵抗。为什么会这样?
正如之前的博客文章中讨论的那样,饭后,胰岛素协调能量的长期储存。然而,在战斗或逃跑反应中,需要随时可用的所有可以动员的能量,因此,期望血液中的葡萄糖和脂肪酸水平升高,以使人能够战斗或逃跑。因此,通过使脂肪细胞产生胰岛素抵抗,脂肪细胞会立即停止从血液中吸收葡萄糖,而是将脂肪酸分泌到血液中,就像处于禁食状态一样。在肝脏中,胰岛素抵抗会引发葡萄糖释放到血液中,就像处于禁食状态一样。在胰岛素抵抗的肌肉组织中,胰岛素也不太能够帮助葡萄糖进入细胞。
在应激反应期间,脂肪组织、肌肉和肝脏会产生胰岛素抵抗,导致血液中两种主要燃料——葡萄糖和脂肪酸——的水平升高。
所有这些作用的结果是,两种主要身体燃料——葡萄糖和脂肪酸——的血液水平增加。这有道理,身体希望确保拥有所需的所有燃料。但肌肉细胞产生胰岛素抵抗有何意义呢?让肌肉继续吸收葡萄糖,以便身体有能量去战斗或逃跑不是更好吗?请记住,如果肌肉收缩(例如在运动中),当与熊战斗或逃离时,肌肉可以以独立于胰岛素的方式从血液中吸收葡萄糖。所以,一切都好。皮质醇和肾上腺素反应会引发各处的胰岛素抵抗,从而提高血糖和脂肪酸水平。但收缩的肌肉能够根据需要从血液中吸收糖分,拥有与熊战斗所需的全部能量,希望能够击败熊。这很神奇。
如果这些天的情况不太好。当你整天坐在办公室里时,你会一次又一次地产生同样的战斗或逃跑反应。只是从你的老板那里收到那封令人不安的电子邮件,因为你对需要做的工作感到紧张,或者因为你有最后期限,并且知道自己做不完。现在你经历了如此多的急性压力反应时刻,以至于压力以及随之而来的皮质醇和肾上腺素水平升高,变成了慢性压力。长期接触这些激素会使您产生胰岛素抵抗。
慢性压力还有另外两个值得注意的后果。其一,有证据表明慢性压力可能引发低度慢性炎症。这听起来可能违反直觉,因为皮质类固醇通常具有抗炎作用,但有数据支持这样的观点,即急性和慢性压力通常与低度慢性炎症有关。正如之前讨论的,低度炎症本身就会诱发胰岛素抵抗。
第二个方面是,在慢性压力的影响下,内脏脂肪库开始积累更多的脂肪。请记住:压力会导致脂肪细胞产生胰岛素抵抗,并释放脂肪酸**。**这些脂肪酸需要去某个地方,往往会部分积聚在内脏脂肪中。因此请注意,这是一个人可能积累大量内脏脂肪的例子,即使没有超过个人脂肪阈值,理论上仍然可以在皮下脂肪库中储存多余的脂肪。慢性压力引起的脂肪细胞中的胰岛素抵抗只是阻止了皮下脂肪的储存。
总而言之,压力会急剧使整个身体出现胰岛素抵抗,还会引发低度炎症反应,从长远来看,会导致内脏脂肪堆积,所有这些都是胰岛素抵抗的主要原因。
**7.睡眠不足**
确实有相当令人信服的数据表明,只要一晚睡眠不足就会显著降低胰岛素敏感。例如,在一项研究中,参与者一晚只能睡 4 小时,另一晚可以睡 8.5 小时。因此,这是为了评估一晚睡眠不足对胰岛素敏感的影响,每次使用第二天早上的金标准钳来测量胰岛素敏感性。即使一晚只少睡 4 小时,睡眠不足后胰岛素敏感也会降低 25%。
只要一晚睡眠不足就会引发胰岛素抵抗。
在另一项研究中,连续一周每晚睡眠时间限制在 5 小时,与正常睡眠时间相比,胰岛素敏感性再次降低了 20%,参与者可以想睡多久就睡多久。
睡眠不足会导致血液中皮质醇水平升高,一项研究表明,人为地保持较低的皮质醇水平可以部分阻断睡眠不足带来的胰岛素抵抗刺激作用。这表明睡眠不足至少部分通过皮质醇水平的增加导致胰岛素抵抗。另一项研究表明,睡眠限制会增加脂肪组织中的游离脂肪酸流量,这表明这可能是睡眠限制降低胰岛素敏感性的另一种机制。还有证据表明,长期睡眠不足的个体中,低度慢性炎症的生物标志物会升高,这也被认为可能介导睡眠不足与胰岛素抵抗之间的关系。
**8. 肠道菌群功能失调**
您可能知道,胃肠道(尤其是结肠)中栖息着大量微生物。现在有大量研究清楚地表明,肠道中的细菌类型及其代谢物与胰岛素抵抗密切相关。现在,正如人们常说的,相关性并不一定等于因果性,因此一项实验特别有趣。研究人员从一群胰岛素抵抗的男性开始,通过一种称为粪便转移积极改变肠道微生物群的组成。这听起来不像是我会很快自愿参与的事情。无论如何,这实际上是一项随机对照试验,男性被随机分配接受直肠输注自己的肠道细菌,或接受来自对胰岛素非常敏感者的肠道细菌。非常有趣的发现是,当这些胰岛素抵抗男性接受来自胰岛素敏感人群的肠道细菌时,通过金标准钳测量,他们的胰岛素敏感性增加了约 70%。因此,根据这些数据,我倾向于这样的观点:肠道微生物组不仅与胰岛素抵抗相关,而且还存在因果关系。
来自瘦身、胰岛素敏感男性的肠道微生物群的转移可提高胰岛素抵抗男性的胰岛素敏感性
这里还有趣的是,肠道微生物组还与我们的整体脂肪量 、内脏脂肪库中储存的脂肪量以及我们是否处于低度慢性炎症状态有关。正如之前在博客文章中讨论的那样,所有这些也决定了是否具有胰岛素抵抗。这是一篇复杂的文献,包含数百篇关于动物模型和人类的科学出版物,将把留到以后的博客文章中,以更详细地讨论这些观察到的相关性背后的因果性的程度。
之后的博客文章中详细讨论肠道微生物群与自身健康之间的关系。届时,还将讨论是否以及如何改变自身的微生物组以改善胰岛素敏感性和与代谢健康相关的其他终点的证据。
**9.昼夜节律不同步**
为了理解这是什么意思,让我们从生物钟开始。
这实际上是超级迷人的。所有人的大脑中都有一个所谓的主时钟。这里无需赘述,主时钟由许多分子组成,其浓度大致以 24 小时为周期上下振荡。主时钟从眼睛接收有关白天还是黑夜的输入,这有助于设置内部主时钟。
大脑包含一个主时钟,接收来自眼睛的光输入,与每个细胞中的各个时钟同步。“时钟”由几个分子组成,其浓度以 24 小时的节奏上下振荡。
主时钟基本上与所有生物过程相关,因为与我们身体每个细胞中的各个时钟相连。通过这种连接,大脑能够影响每个组织在任何给定时间所做的事情。这就是所说的昼夜节律,昼夜节律一词指的是以 24 小时为周期重复发生的过程。
通常,在白天天亮时就醒了,这也是吃饭的时间。因此,如果在晚上将自己暴露在光线下,或者在晚上进食,就会扰乱正常的昼夜节律,这意味着昼夜节律不同步。
从历史上看,在有电力之前,人类可能在白天吃掉大部分或全部热量,因此,身体代谢食物的能力在一夜之间减弱,这也许并不令人惊讶。因此,葡萄糖耐量(将血糖保持在正常范围内的能力)在晚上低于早上,然后在夜间进一步下降。
那么,为什么这很重要呢?其一,深夜甚至晚上吃东西的人,例如上夜班,与白天吃同样的饭菜相比,高碳水食物的血糖水平预计会更高。还从观察性研究中获得大量证据,表明经常上夜班的人往往比晚上睡觉的人更容易产生胰岛素抵抗。他们的体重也往往会增加,这使得这些数据难以解释:这些观察是否表明夜班工作直接影响胰岛素敏感性,或者经常上夜班只是导致热量摄入过多,然后体重和体脂增加?脂肪量往往会使人更容易产生胰岛素抵抗?
确实有一些证据表明,即使体重或成分没有任何变化,严重扰乱正常的昼夜节律也会在短短几天内导致胰岛素抵抗。这已在实验室研究中得到检测。参与者以随机顺序两次来到一个没有窗户的房间里呆几天。
在房间停留期间,研究人员在参与者的生物钟习惯之外重新创建了正常的昼夜节律。当外面阳光明媚时,房间里明亮起来,参与者们活跃地吃饭。当外面是晚上时,关掉灯,参与者按照他们的生物钟睡觉。
在第二次停留期间,随着时间的推移,研究人员将正常的昼夜节律改变了 12 个小时,这样几天后,当外面是白天时,房间里一片漆黑,参与者就睡觉了。当外面是晚上时,把房间照亮,参与者都醒着、活跃并吃饭。这些条件之间的食物摄入量和睡眠时间是匹配的,但在实验室模拟的夜班条件结束时,参与者的胰岛素抵抗要强得多,而体重条件之间没有差异。
夜间工作(以及暴露在光线下和进食)可能会导致胰岛素抵抗,例如夜班工作者。这种效应可以在几天内触发,在此期间,研究参与者在没有窗户的房间里进行人工夜班。
**10.青春期**
身体通常会在两种生理状态下产生胰岛素抵抗,青春期就是其中之一。效果相当大,青春期男孩 和女孩的胰岛素敏感性均降低约 20-40% 左右。这种效应是可逆的,因此到青春期结束时,会恢复到青春期前的胰岛素敏感性。
**11.怀孕**
这是胰岛素抵抗发生的第二种生理状态。
随着正常怀孕的进展,母亲的胰岛素抵抗会越来越强,与怀孕前或 怀孕后 相比,到妊娠晚期通常胰岛素敏感度会降低 40-60 %。如果女性能够通过产生更多的胰岛素来补偿这种巨大的胰岛素抵抗,将保持葡萄糖耐受性,但孕妇常常无法完全补偿,在这种情况下,会变得葡萄糖不耐受,并可能发展为妊娠期糖尿病。由于胰岛素抵抗是短暂的,一旦婴儿出生,妊娠期糖尿病可能会再次缓解。
**12. 某些药物**
众所周知,有几类药物会导致胰岛素抵抗。其中特别包括抗逆转录病毒药物(治疗艾滋病毒感染的药物)、第二代抗精神病药物和皮质类固醇。这并不是一份详尽的清单,我想在这里指出的要点是,如果长时间服用任何药物,我认为需要与医生讨论该药物是否会导致例如体重增加、胰岛素抵抗或其他副作用。显然,不要仅仅因为担心胰岛素抵抗而停止服药,相反,请务必与医生讨论自己的担忧。
**13. 某些医疗状况**
有相当多的医疗状况会导致胰岛素抵抗。
从我们已经讨论过的情况来看,这包括所有急性感染和所有慢性炎症,包括自免疾病,这不足为奇。根据经验,炎症越严重,身体受炎症影响的部分越高,全身胰岛素敏感受损的可能性就越大。因此,如果大脚趾有一点感染,大脚趾就会产生胰岛素抵抗,但身体的其他部位不会受到太大影响。然而,如果患有严重的自免疾病,影响身体的大部分或多个组织,例如狼疮,很可能会出现严重的胰岛素抵抗。
接下来是影响体内激素水平的状况。甲状腺疾病是一种常见疾病,因为甲状腺功能亢进和甲状腺功能减退都与胰岛素抵抗有关**。**库欣病是另一个例子。在库欣病中,身体长期产生过多的皮质醇,就像慢性压力引起的皮质醇水平增加会导致胰岛素抵抗一样,库欣病也是如此。
这里值得一提的另一种常见疾病是睡眠呼吸暂停。睡眠呼吸暂停与胰岛素抵抗有关,但观察数据不能高度可信地告诉我们睡眠呼吸暂停是否会引发胰岛素抵抗,或者睡眠呼吸暂停患者是否仅因超重或肥胖而存在胰岛素抵抗。因此,值得注意的是,用 CPAP(即持续气道正压通气)治疗睡眠呼吸暂停可改善胰岛素敏感,这表明所观察到的睡眠呼吸暂停与胰岛素抵抗之间存在因果关系。
然后我想提一下与胰岛素抵抗相关但因果关系有些复杂的疾病:多囊卵巢综合征(PCOS)。这很复杂,因为胰岛素抵抗很可能是多囊卵巢综合症的原因或后果。许多读者都要求撰写有关 PCOS 的单独文章,我可能很快会更详细地解决这个问题。
**14.更年期**
当女性经历更年期时,由于多种潜在原因,胰岛素敏感性往往会下降。激素的变化通常会导致体重增加,而根据个人脂肪阈值,这本身可能会导致内脏脂肪和异位脂肪量的增加。除了体重增加之外,女性的体脂分布也会发生变化,甚至与体重增加无关,内脏脂肪量也会增加。正如人们所预测的那样,内脏脂肪量的增加与胰岛素抵抗的增加有关。最后,更年期期间发生的激素变化也可能导致胰岛素抵抗,而与对体脂量和分布的影响无关。
**15. 老年**
年龄越大,胰岛素抵抗程度越高 。人们认为,随着年龄的增长,胰岛素敏感降低与随着年龄的增长而发生的身体成分的许多变化有关。**其一,衰老与肌肉质量减少**有关,而正如之前讨论的,低肌肉质量与胰岛素抵抗有关。这种与衰老相关的肌肉质量损失称为肌少症。衰老肌肉中似乎也存在功能和分子变化,导致肌肉胰岛素抵抗。衰老还与体脂分布的变化有关,即皮下脂肪量减少和内脏脂肪量增加。因此,换句话说,个人脂肪阈值似乎会随着年龄的增长而下降,即使总体上没有增加脂肪量,也可能会增加内脏脂肪。
除了身体成分的这些变化之外,还要考虑睡眠不足、某些医疗状况和药物摄入量随着年龄的增长而增加,也可能导致老年人胰岛素敏感降低。正如刚才讨论的,对于女性来说,其中一种情况是更年期,似乎会加速内脏脂肪量和胰岛素抵抗的增加,而这些通常是随着衰老而发生的。
我看到的数据表明,如果避免肌肉质量的损失、脂肪质量的增加以及随着年龄增长而出现的并发症,那么随着年龄的增长,应该能够保持相当正常的胰岛素敏感性。显然,说起来容易做起来难,但我想说的是,也许衰老本身并不一定那么消极,而是随之而来的体重增加和久坐的生活方式。
**16.不良饮食习惯**
现在我这是一个营养网站,如果我匆忙地介绍与胰岛素抵抗相关的所有饮食因素,我会对读者造成伤害。因此,我将在这里调侃一下,在接下来有 20 篇左右的博客文章中,将讨论各种各样的饮食因素,包括热量摄入量、酒精、各种维生素、矿物质和微量元素、晚期糖基化终产物、碳水化合物、脂肪、蛋白质的作用,当然还有特定碳水化合物或脂肪的作用,如果糖、长链饱和脂肪酸、中链和短链脂肪酸;益生菌和益生元、不同的香料和补剂,不仅讨论这些与胰岛素抵抗的关系,还详细介绍如何利用这些因素来提高胰岛素敏感。
**总结和结论**
我希望您现在能够认识到,胰岛素抵抗的原因不是单一的。因此,重要的是要清楚个人接触到的这些因素中的哪些,因为为了使胰岛素敏感正常化,需要解决具体的原因。
胰岛素抵抗的 16 大原因
在我看来,这在现代临床医学中做得太少了。胰岛素抵抗本身没有任何症状,在初级保健中通常被忽视。只有当出现高血糖或糖尿病时,才会开始干预,但只能通过治疗高血糖,而不总是试图解决胰岛素抵抗或其根本原因。
当考虑可能引发胰岛素抵抗的不同因果因素时,要清楚认识到,对于每一个因素,通常都存在剂量反应关系,例如,一点点内脏脂肪和异位脂肪会导致轻微的胰岛素抵抗,而大量的内脏脂肪加上严重的脂肪肝会导致严重的胰岛素抵抗。如果正在服用皮质类固醇药物,情况也是如此:几天服用低剂量与长时间服用高剂量会产生截然不同的效果。
另外,请考虑这些不同触发因素的影响可能是累积的。例如,如果一个身材瘦削且高度活跃的女孩进入青春期,她的胰岛素敏感性会恶化,但会从非常好变为良好。然而,如果腹部肥胖的女孩进入青春期,胰岛素敏感性可能会从较差恶化到非常差,然后该女孩可能有患2型糖尿病的风险。
最后,让我明确一点,本文中提到的一些胰岛素抵抗的潜在原因造成了一些先有鸡还是先有蛋的问题。例如,低肌肉质量确实会导致胰岛素抵抗,但胰岛素抵抗也会使增加肌肉质量变得更糟。同样,胰岛素抵抗被认为在多囊卵巢综合症的发展中发挥了作用,但多囊卵巢综合症也被认为会降低胰岛素敏感。这实际上是该文献中的典型内容:因为胰岛素在体内的许多生物过程中发挥着如此重要的作用,胰岛素抵抗和由此导致的高胰岛素血症也会产生许多下游影响,因此并不总是容易的,甚至是不可能的首先清楚说明是什么导致了什么。
我希望本文能提供有用的信息,能带您走上预防或逆转胰岛素抵抗的道路。信息相当多,我很抱歉,由于必要,我必须在这里以某种肤浅的方式涵盖所有这些胰岛素抵抗的触发因素。在未来的文章中讨论逆转胰岛素抵抗的不同策略时,将更详细地讨论每个策略,包括可以对饮食和生活方式做出的具体改变,以在理想情况下使胰岛素敏感性正常化。
照顾好自己!
**参考**
- 疾病预防与控制中心。国家糖尿病统计报告。2022 年 6 月 29 日。访问日期:2023 年 10 月 2 日。
- 帕尔查等人;非糖尿病美国年轻人的胰岛素抵抗和心脏代谢风险状况:来自 NHANES 的见解。临床内分泌与代谢杂志 2022;107:e25-e37。
- 国际糖尿病基金会(IDF)。IDF 糖尿病图谱。2021 年全球糖尿病。访问日期:2023 年 10 月 2 日。
- 陈等人;胰岛素受体贩运:对胰岛素敏感性和糖尿病的影响。国际分子科学杂志2019;20:5007。
- 岑等人;**人类和小鼠肌肉转录组分析发现高胰岛素血症相关胰岛素抵抗中胰岛素受体 mRNA 下调。**FASEB 期刊 2021;36:e22088。
- Yki-Yaervinen 等人;急性感染期间胰岛素抵抗的严重程度、持续时间和机制。临床内分泌与代谢杂志1989;69:317-23。
- 桑切斯-佩雷斯等人;系统性红斑狼疮患者的胰岛素抵抗:影响因素及其与亚临床动脉粥样硬化的关系。临床与实验风湿病学2017;35:885-92。
- 特瓦里等人;与身体成分、肥胖和碳水化合物治疗相关的术后炎症和胰岛素抵抗:一项随机对照研究。临床营养学2019; 38:204-12。
- 金和朴。韩国成年人肌肉质量和脂肪质量与胰岛素抵抗和代谢综合征患病率的关联:一项横断面研究。2018 年科学报告;8:2703。
- 海恩斯等人;肌肉质量和胰岛素敏感性之间的关联与超重/肥胖的年轻人中有害的脂肪库无关。国际肥胖杂志 2020;44:1851-8。
- 斯里坎坦和卡尔曼格拉。相对肌肉质量与胰岛素抵抗和糖尿病前期呈负相关。第三次全国健康与营养状况调查结果。临床内分泌与代谢杂志2011;96:2898-903。
- 斯莫拉温斯基等人;**三天卧床休息对经过耐力或力量训练的运动员和未经训练的受试者的代谢、激素和循环对口服葡萄糖负荷的反应的影响。**生理学与药理学杂志2000;51:279-89。
- 汉堡等人;缺乏身体活动会迅速诱发健康志愿者的胰岛素抵抗和微血管功能障碍。动脉硬化血栓形成与血管生物学2007;27:2650-6。
- 鲍登·戴维斯等人;短期体力活动减少和久坐行为增加会导致代谢紊乱和身体成分改变:对有或没有患有 2 型糖尿病的一级亲属的个体都有影响。糖尿病学2018;61:1282-94。
- 李等人;急性心理应激导致胰岛素抵抗迅速发展。内分泌学杂志2013; 217:175-184。
- 克鲁特等人;由于胰腺β细胞功能下降和胰岛素抵抗增加,没有糖尿病的健康蹦极运动员会出现压力引起的高血糖。糖尿病技术与治疗2012;14:311-4。
- 戴伯特等人;肾上腺素诱导的人类胰岛素抵抗。临床研究杂志1980;65:717-21。
- 罗勒德。社会心理压力刺激全身低度炎症。心身医学2014; 76:181-9。
- 拉杰等人;脂肪细胞脂肪分解驱动急性应激诱导的胰岛素抵抗。2020 年科学报告;10:18166。
- 珀内尔等人;皮质醇生成率、游离皮质醇和 11β-HSD-1 表达的增强与男性内脏脂肪和胰岛素抵抗相关:减肥的效果。美国生理学、内分泌学和代谢杂志 2009;296:E351-7。
- 东加等人。; 一晚部分睡眠不足会在健康受试者的多种代谢途径中诱发胰岛素抵抗。临床内分泌与代谢杂志2010;95:2963-8。
- 巴克斯顿等人;**限制睡眠 1 周会降低健康男性的胰岛素敏感性。**糖尿病 2010;59:2126-33。
- 哈克特等人;2 型糖尿病患者睡眠问题与皮质醇之间的关系。心理神经内分泌学2020; 117:104688。
- 刘等人;抑制皮质醇和睾酮可减轻男性睡眠限制期间胰岛素抵抗的发展。临床内分泌与代谢杂志 2021;106:e3436-48。
- 布鲁萨德等人;睡眠限制会增加健康男性的游离脂肪酸。糖尿病学2015;58:791-8。
- 辛格等人;睡眠不足会增加出现胰岛素抵抗的风险吗?系统回顾。库鲁斯 2022;14:e23501。
- 詹森和克尔斯滕。**肠道微生物群在代谢健康中的作用。**FASEB 期刊 2015;29:3111-23。
- 李等人;**肠道微生物组及其在肥胖和胰岛素抵抗中的作用。**2020 年纽约科学院年鉴;1461:37-52。
- 吴等人;糖尿病前期和糖尿病中的肠道微生物群:一项基于人群的横断面研究。细胞代谢2020;32:379-90。
- 张等人;将肠道微生物代谢物与胰岛素抵抗联系起来的机制。世界糖尿病杂志 2021;12:730-44。
- 弗里兹等人;从瘦捐献者转移肠道微生物群可提高代谢综合征患者的胰岛素敏感性。胃肠病学2012; 143:913-6。
- 莱伊等人;人类肠道微生物与肥胖有关。自然2006;444:1022-3。
- 里达乌拉等人;与肥胖不一致的双胞胎的肠道微生物群调节小鼠的新陈代谢。科学2013;341:1241214。
- 特恩博等人;与肥胖相关的肠道微生物组具有增强的能量收集能力。自然2006;444:1027-31。
- 韩等人;**基于定量计算机断层扫描的内脏肥胖患者肠道微生物组的变化。**细胞和感染微生物学前沿 2022;11:823262。
- 勒罗伊等人;**剖析肠道微生物群和饮食对内脏脂肪堆积的作用。**2019 年科学报告;9:9758。
- 坎贝尔等人;肠道微生物群与宿主免疫之间的串扰:对炎症和免疫治疗的影响。生物医学 2023;11:294。
- 萨阿德等人;**将肠道微生物群和炎症与肥胖和胰岛素抵抗联系起来。**生理学2016; 31:283-93。
- 奥斯特曼等人;**生物钟、轮班工作和组织特异性胰岛素抵抗。**内分泌学2020;161:1-11。
- 韦弗斯等人;**昼夜节律失调会诱导脂肪酸代谢基因谱并损害人体骨骼肌的胰岛素敏感性。**2018 年美国国家科学院院刊;115:7789-94。
- 斯坦弗斯等人;**昼夜节律时钟和胰岛素抵抗。**自然评论内分泌学 2019;15:75-89。
- 布洛赫等人;**青春期会降低胰岛素敏感性。**儿科杂志1987;110:481-7。
- 汉农等人;**生理性胰岛素抵抗和青春期代谢变化的纵向研究。**儿科研究2006;60:759-63。
- 莫兰等人;**青春期的胰岛素抵抗。对 357 名儿童进行钳夹研究的结果。**糖尿病 1999;48:2039-44。
- 表兄弟姐妹。**怀孕期间的胰岛素敏感性。**糖尿病 1991;40 补编 2:39-43。
- 厄斯德科夫·斯卡亚 (Oesdkov Skajaa) 等人;**妊娠期糖尿病女性妊娠期间和产后胰岛素敏感性和胰岛素分泌的变化。**英国医学杂志开放式糖尿病研究与护理 2020;8:e001728。
- 斯坦利等人;**人类妊娠期胰岛素抵抗的生理变化:高胰岛素血症正常血糖钳夹技术的纵向研究。**英国妇产科杂志1998;105:756-9。
- 巴伯等人;**正常妊娠和妊娠糖尿病中胰岛素抵抗的细胞机制。**糖尿病护理2007;30 补充2:S112-9。
- 费夫和希恩。**当治疗药物导致糖尿病时。**糖尿病学 2022;65:751-62。
- 加西亚-卡拉斯科等人;**系统性红斑狼疮患者的胰岛素抵抗和糖尿病。**内分泌、代谢和免疫紊乱——2023 年药物目标;23:503-14。
- 吉拉赫等人;**胰岛素抵抗和甲状腺疾病。**波兰内分泌学2014;65:70-6。
- 巴博特等人;**继发于库欣病的糖尿病。**内分泌学前沿 2018;9:284。
- 卡萨尔等人;**多囊卵巢综合征的胰岛素抵抗:正常血糖-高胰岛素血症钳夹研究的系统回顾和荟萃分析。**人类生殖2016;31:2619-31。
- 巴伯等人;**多囊卵巢综合征:深入了解发病机制以及与胰岛素抵抗的常见关联。**临床医学2016; 16:262-6。
- 哈施等人;**胰岛素抵抗和阻塞性睡眠呼吸暂停综合征的其他代谢方面。**医学科学监测2005;11:RA70-5。
- 伊夫蒂哈尔等人;**荟萃分析:持续气道正压通气可改善非糖尿病睡眠呼吸暂停患者的胰岛素抵抗。**2013 年美国胸科学会年鉴;10:115-20。
- 斯洛皮恩等人;**更年期和糖尿病:EMAS 临床指南。**2018 年成熟;117:6-10。
- 切尔诺夫等人;更年期、中心体脂肪和胰岛素抵抗:激素替代疗法的影响。冠状动脉疾病1989;9:503-11。
- 罗等人;**衰老胰岛素抵抗的表征。**临床研究杂志1983;71:1581-7。
- 芬克等人;**衰老过程中胰岛素抵抗的机制。**临床研究杂志1983;71:1523-35。
- 埃尔哈特等人;**衰老对小鼠和人类胰岛素敏感性和清除率的非肥胖依赖性影响。**2019 年肥胖;27:434-443。
- 克莱斯比等人;**胰岛素抵抗和肌肉减少症:常见并发症之间的机制联系。**内分泌学杂志2016; 229:R67-81。
- 寿等人;**衰老骨骼肌胰岛素抵抗风险增加的机制。**糖尿病学和代谢综合征 2020;12:14。
- 亨特等人;**内脏脂肪与年龄相关的变化。**国际身体成分研究杂志2010;8:103-8。
- Bannebjerg Baarts 等人;**整个生命周期中内脏脂肪量的年龄和性别特异性变化。**肥胖 2023;31:1953-61。
- 博内瓦-阿西奥娃和博亚诺夫。**通过生物电阻抗分析和计算机断层扫描评估与年龄相关的身体成分和腹部脂肪组织的变化。**内分泌与营养学2011;58:472-7。
https://nourishedbyscience.com/insulin-resistance-top-causes/
</markdown>
D:2023.10.19
<markdown> </markdown>